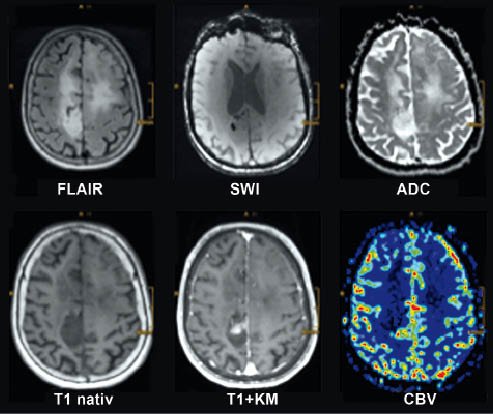
Auf der FLAIR-Wichtung hyperintenser Tumor in der Zentralregion rechts (primäre Tumorlokalisation) und beidseits frontal bei infiltrativem Wachstum über den Balken. Verkalkung auf der SWI-Bildgebung (gehört nicht zur Standardbildgebung). Inhomogener Tumor in der ADC-Karte mit nur partieller Kontrastmittelaufnahme und CBV-Erhöhung in der Perfusionsbildgebung (ebenfalls keine Standardbildgebung).
Artikel • Hirn mit Hirn
Strukturelle Bildgebung des Gehirns
Für niedergelassene Radiologen hat Professor Irina Mader von der Schön-Klinik Vogtareuth eine sehr beruhigende Nachricht: Mit der strukturellen Bildgebung lassen sich die wesentlichen und wichtigen Aspekte von Hirntumoren bereits beurteilen. In ihrem Gespräch mit radiologia bavarica erläutert sie die Feinheiten und verrät die wichtigsten Tricks für eine tiefgreifende Diagnostik.
Bericht: Marcel Rasch
„Grundsätzlich reicht die strukturelle Bildgebung, zum Beispiel T2, FLAIR, T1 ohne und mit Gadolinium sowie die Diffusionsbildgebung (ADC) aus, um gemäß den Empfehlungen der Neuroonkologischen Arbeitsgemeinschaft (NOA) (https://www.neuroonkologie.de/leitlinien) Hirntumore zu beurteilen, nimmt Prof. Mader vorweg. „Da die Perfusionsbildgebung von den Krankenkassen nicht übernommen wird, ist der Niedergelassene auf die Diffusion angewiesen. Zudem verfügen viele Praxen über keinen für die Perfusionsbildgebung erforderlichen Injektor, da ist es gut zu wissen, dass man mit der strukturellen Bildgebung ebenfalls gute Ergebnisse erzielen kann.“
Empfohlen werden unter anderem T1-gewichtete Aufnahmen in 3D ohne und mit Kontrastmittel. Vor allem isotrope 3D-Datensätze mit Gadolinium sind wichtig für die OP-Planung und die Neuronavigation. „Das hilft, Doppeluntersuchungen vermeiden“, so Mader. „Als Daumenregel gilt: Nimmt der Tumor präoperativ Kontrastmittel auf, nutzt man den 3D-T1-gewichteten Datensatz mit Kontrastmittel; nimmt er kein Kontrastmittel auf, sollte eine 3D-gewichtete-T2 oder FLAIR-Gewichtung ergänzt werden.
Wege zur Diagnose
„Erst nach Feststellung von Kriterien wie dem Alter des Patienten und der Lokalisation des Tumors wendet man sich der Signalintensität der Läsion zu. Dabei weisen eine relative Signalarmut in der T2-gewichteten Sequenz und eine ADC-Signalabsenkung auf hyperzelluläre Tumore hin. „Das ist hinlänglich bekannt“, erklärt Mader. Eine Neuigkeit hat die Neuroradiologin doch auf Lager: „Auf der Suszeptibilitäts-gewichteten Sequenz (SWI) werden Signalabsenkungen („intratumorales Suszeptibilitäts-Signal, ITSS“) als Hinweis auf ein Glioblastom gewertet, nicht jedoch auf ein Lymphom.“
Von der Identifikation eloquenter Areale hängt unter anderem die Prognose ab, so Mader: „Liegt ein Tumor in einem eloquenten Areal vor, kann dieser nicht vollständig reseziert werden, was bei einem Gliom in einer schlechteren Prognose endet.“ Auch die Größe spielt verständlicherweise eine Rolle. „Ist der Tumor zu groß oder in Teilen in eloquente Areale eingewachsen, kann er ebenfalls nicht vollständig reseziert werden“, verdeutlicht Mader. Spektroskopie und Perfusion kommen erst bei der Genetik und Prognoseabschätzung ins Spiel.
Ein typischer Fall
Der Wert der strukturellen Bildgebung zeigt sich bespielhaft auch beim Oligodendrogliom (Abb.), das über einen sehr spezifischen genetischen Abdruck verfügt. Nur wenn eine IDH-Mutation zusammen mit einer 1p19q-Codeletion vorliegt, darf tatsächlich von einem Oligodendrogliom gesprochen werden. „In unserem Fall ist in der FLAIR-Sequenz gut erkennbar, dass in der rechten Zentralregion der Tumor am solidesten ist. Aufgrund der Lage im Gyrus präzentralis wurde der Tumor nicht reseziert, sondern nur biopsiert. Danach ist der Tumor erst nach frontal und dann über den Balken auf die Gegenseite gewachsen. Allein in der FLAIR-Aufnahme sieht man, dass dieser Tumor langsam wachsend ist. Man kann zudem die Oligodendrogliom-typischen Verkalkungen auf der SWI-Sequenz erkennen; ferner lässt sich feststellen, dass die Diffusion in der ADC-Karte inhomogen ist. Dies ist genau die Stelle, an der in der T1-gewichteten Sequenz mit KM eine Kontrastmittelanreicherung zu sehen ist. In der Perfusion lässt sich hier eine entsprechende Erhöhung des cerebralen Blutvolumens (CBV) erkennen“, erläutert Mader diesen Fall.
Quantifizierung struktureller Bildgebung

In der strukturellen Bildgebung gibt es die Vasari-Kriterien, die ein strukturiertes Vokabular zur reproduzierbaren visuellen Auswertung bieten (unter folgendem Link als Tabelle abrufbar: https://wiki.nci.nih.gov/display/cip/vasari).
Darin werden 25 Kriterien der Standardbildgebung inklusive Diffusion erfasst, die auf einem Consensus von drei neuroradiologischen Experten anhand von 33 individuellen Gliomen für die NCI-„Rembrandt“-Collection des Cancer Imaging Programms basieren. „Sie beschreiben Kriterien für die Lokalisation eines Tumors in Hirnlappen, Insel, Hirnstamm und Kleinhirn, für unterschiedliche eloquenten Areale, die Qualität der KM-Anreicherung inklusive des KM-anreichernden Anteils in Prozent. An diesem Punkt werden die Vasari-Kriterien allerdings unhandlich, weil der Prozentanteil in der Routinebefundung nicht so einfach beurteilbar ist. Daher sind diese Kriterien vor allem für Studien verwendbar“, so Mader.
Nichtsdestotrotz finden sich ein paar interessante Details in den Kriterien, wie die Unterscheidung zwischen multifokal und multizentrisch. „Multifokal bedeutet weitere Tumoranteile außerhalb von Haupttumor und Ödem, mit Ausbreitung entlang der Faserbahnen, während multizentrisch das Auftreten außerhalb „etablierter“ Routen, außerhalb von Haupttumor und Ödem beschreibt“, erläutert Mader. Auch das Verhältnis von nativer T1-Wichtung und FLAIR ist wichtig. „Stimmen die FLAIR-Hyperintensität und die T1-Hypointensität überein, spricht man von einem „expansiven Wachstum, ist die FLAIR-Hyperintensität größer als die T1-Hypointensität, von einem infiltrativen Wachstum. Interessant ist dies deshalb, weil infiltrative Tumoren grundsätzlich eine schlechtere Prognose haben. „Diesen Aspekt, kann jeder Radiologe ohne weitere Verfahren oder Sequenzen einfach nachvollziehen.“
Die Zukunft der Bildgebung und Spektroskopie
Wichtig sind Ansätze mit strukturierter qualitativer Auswertung und quantitativen Maßen, die aus Texturanalysen gewonnen werden können. Diese Parameter können in Machine Learning-Verfahren eingespeist werden. Die Hoffnung ist, dass man damit in Zukunft diagnostische, prognostische oder auf den Patienten individualisierte Aussagen machen kann. Momentan sind solche Ansätze noch Gegenstand der Forschung.
In der Spektroskopie wurde viel über „2-Hydroxyglutarat (2HG)“ publiziert, einen Marker für die Isozitratdehydrogenase (IDH)-Mutation. Die direkte Spektroskopie von 2HG ist allerdings schwierig, weil entweder Spectral Editing verwendet werden oder der Metabolit suffizient mittels eines besonderen Fit-Programmes angefittet werden muss“, erläutert Mader. Daher wurde 2017 die so genannte SPORT-Studie (Spectroscopic Prediction of GenOmics of bRain Tumors) in Freiburg geplant und beantragt, bei der Standardsequenzen und eine Standardauswertung zur Anwendung kommen.
Professor Mader: „SPORT ist eine prospektive Studie an Patienten mit V. a. Gliom vor der ersten Operation, die präoperativ eine Standard-Spektroskopie erhalten.“ Die Spektren werden daraufhin den Arealen „kontrastmittel-aufnehmender Tumor“, „nicht kontrastmittel-aufnehmender Tumor, FLAIR hyperintenser Tumor“ und „normal erscheinende Substanz“ zugeordnet. „Mit der Konsole des Herstellers ist das zu realisieren, geplant ist der Einbau in ein Webtool“, verdeutlicht Mader das Projekt. Ziel ist es, mittels Deep Learning eine Unterscheidung der Gruppen „IDH wildtyp“, „IDH mutiert ohne 1p19q Codeletion“ und „IDH mutiert mit 1p19q Codeletion“ zu erlernen und später vorherzusagen.
„Ein Proof of Concept bei 65 Patienten hat ergeben, dass „IDH wildtyp“ und „IDH mutiert“ sich mittels Laktat unterschieden lassen, da im Wildtyp der Laktatwert höher liegt. Für die Differenzierung der 1p19q Codeletion müssen mehrere Metaboliten herangezogen werden. Die Voraussetzungen für eine ausreichende Varianz der Daten ist allerdings gegeben, um eine erfolgreiche Vorhersage mittels Machine Learning erhalten zu können“, so Mader. Die Studie befindet sich derzeit noch im Begutachtungsverfahren der Deutschen Forschungsgemeinschaft.
RANO-Kriterien zur Verlaufskontrolle
In der Verlaufskontrolle greifen die mittlerweile bekannten RANO-Kriterien (Response Assessment in NeuroOncology) für High Grade Gliome, Low Grade Gliome, Metastasen und Immuntherapie. „Das RANO-Zeitfenster von 12 Wochen nach Ende der Bestrahlung sollte bekannt sein und wurde hinreichend beschrieben“, so Mader. Es besagt, dass bis 12 Wochen nach Ende der Bestrahlung eine Zunahme des kontrastmittelaufnehmenden Tumoranteils oder eine neue Kontrastmittaufnahme innerhalb des bestrahlten Volumens nicht als Progress gewertet dürfen. „Erkennen wir nach 12 Wochen eine Zunahme der Summe aller in T1 mit KM messbaren Flächenmaße von über 25 Prozent, dürfen wir von einem Progress sprechen. Unter 25 Prozent ist es eine „stable disease“, fasst Mader zusammen.
Dank Perfusion lassen sich Rezidiv und Strahlenreaktion besser unterscheiden. „Interessanterweise ist der Unterschied des CBV zwischen den einzelnen Untersuchungszeitpunkten ein besseres Maß für das Rezidiv“, so Mader, „da der Rezidivtumor ein höheres und ansteigendes CBV hat. CBV ist nicht in den RANO-Kriterien beschrieben, da diese nur die Standardbildgebung beinhalten.“
Profil:
Prof. Dr. Irina Mader war bis Ende 2017 Oberärztin in der Klinik für Neuroradiologie des Universitätsklinikums Freiburg, wo einer ihrer Schwerpunkte in der Neuroonkologie lag. Seit Anfang 2018 ist sie in der Schön-Klinik Vogtareuth im Bereich ihres anderen Schwerpunktes tätig: Pädiatrische Neuroradiologie und Epilepsie.
Veranstaltungshinweis:
Freitag, 28. September 2018, 13:50–14:10
Raum: Tesla-Saal
Session: Symposium 6 – Refresher Course: ZNS Tumore
Hirntumore bei Erwachsenen – multimodale Bildgebung
Prof. Dr. Irina Mader (Vogtareuth)
29.09.2018