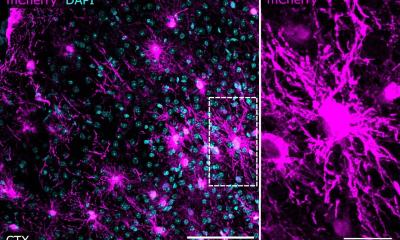
© DKFZ
News • Glioblastom
Forscher entschlüsseln, wie sich Hirntumoren entwickeln
Nur drei verschiedene Erbgutveränderungen treiben die frühe Entwicklung bösartiger Glioblastome an, fanden Wissenschaftler vom Deutschen Krebsforschungszentrum in einer aktuellen Untersuchung. Bei allen untersuchten Tumoren lag mindestens einer dieser drei Krebstreiber vor. Doch erst eine Aktivierung der Telomerase sorgt schließlich für rasantes Größenwachstum.
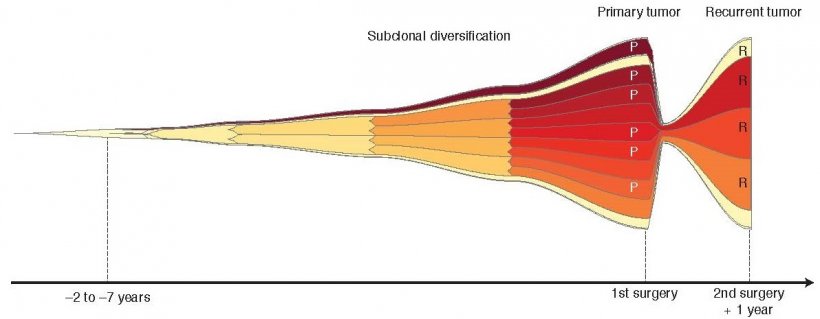
Bis zu sieben Jahre entwickeln sich die Glioblastome, bevor sie sich durch Symptome bemerkbar machen und diagnostiziert werden. Doch im Gegensatz zu ihrer frühen Entwicklung teilen Glioblastome, die nach der Therapie zurückkehren, so gut wie keine übereinstimmenden Erbgutveränderungen.
Glioblastome sind die häufigsten bösartigen Hirntumoren beim Erwachsenen. Da sie diffus in das gesunde Hirngewebe einwachsen, gelingt es den Chirurgen nur selten, den Tumor komplett zu entfernen. Daher kehren Glioblastome trotz der an die Operation anschließenden Strahlen- und Chemotherapie sehr häufig schnell zurück und gelten dann nach heutigem Kenntnisstand als unheilbar. „Es gab die Theorie, dass möglicherweise bestimmte Mutationen die Glioblastomzellen dazu befähigen, die Standard-Radiochemotherapie zu überleben und dann zu resistenten Subklonen des Tumors auszuwachsen. Unsere Frage war daher: Übt die Therapie einen bestimmten Selektionsdruck auf die Tumorzellen aus?" erklärt Peter Lichter vom Deutschen Krebsforschungszentrum (DKFZ) sein aktuelles Forschungsprojekt. Für die Entwicklung neuer Medikamente, die auch gegen die zurückgekehrten Tumoren wirksam sind, ist es entscheidend, solche genetischen Merkmale zu identifizieren, die es den Krebszellen ermöglichen, sich der Therapie zu entziehen.
Dieser Artikel könnte Sie auch interessieren
News • Aggressive Hirntumore
Fortschritt bei der Therapie des Glioblastoms
Krebsforscher der Universität Bonn vermelden einen bedeutenden Fortschritt bei der Behandlung des Glioblastoms. Rund ein Drittel aller Patienten leiden unter einer bestimmten Variante dieses häufigsten und aggressivsten Hirntumors. Sie überlebten mit der neuen Therapie im Schnitt um die Hälfte länger als Betroffene, die die Standardtherapie erhielten.
Um das herauszufinden, untersuchte Lichter gemeinsam mit dem Systembiologen Thomas Höfer vom DKFZ Glioblastom-Gewebeproben von insgesamt 50 Patienten, bei denen sie Material vom Primärtumor und vom Rezidiv direkt miteinander vergleichen konnten. Basierend auf einer sorgfältigen Analyse des Tumorerbguts konnten die Forscher ein mathematisches Modell der Tumorentwicklung konstruieren. Dazu nutzten sie Mutationsraten sowie Schätzungen der Tumorzellzahl. „Wir haben sozusagen die Evolutionswege der Glioblastomzellen und den Einfluss ihrer Genmutationen während des Tumorwachstums am Rechner nachgestellt", beschreibt Höfer das Vorgehen.
Die überraschenden Ergebnisse dabei: Zum Zeitpunkt der Diagnose hat sich ein Glioblastom bereits über sehr lange Zeit, teilweise bis zu sieben Jahre, entwickelt, errechneten die Forscher. „Das ist angesichts des extrem schnellen Wachstums von Glioblastomen kaum vorstellbar", so Verena Körber, die Erstautorin der aktuellen Arbeit. „Doch wir können das dadurch erklären, dass zu Anfang immer wieder viele Krebszellen absterben, erst ab einen bestimmten Moment geht das rasante Größenwachstum los.
Das zeigt, dass wir grundsätzlich neuartige Behandlungsformen brauchen, um Glioblastome wirksam behandeln zu können
Peter Lichter
Diesem entscheidenden Moment sind die Forscher auch auf die Spur gekommen: Während ihrer frühen Entwicklung weisen alle untersuchten Glioblastome mindestens eine von drei charakteristischen Erbgutveränderungen auf (Zugewinn des Chromosom 7, Verlust auf Chromosom 9p oder 10). Diese Chromosomen-Verluste- oder Zugewinne stehen im Zusammenhang mit bekannten, spezifischen „Treiber-Mutationen", die die Krebsentstehung fördern. Doch rasantes Größenwachstum nehmen die Glioblastome offensichtlich erst dann auf, wenn zusätzlich eine Mutation den Genschalter für das Telomerase-Gen dauerhaft aktiviert. Das Enzym Telomerase sorgt dafür, dass die Krebszellen sich nun unendlich teilen können und nicht nach einer gewissen Zahl von Zellteilungen an ihr natürliches Limit kommen und absterben. In gesunden Zellen ist das Gen für die Telomerase daher in der Regel nicht aktiv. Während ihres exponentiellen Wachstums sammeln sich in den Krebszellen zahlreiche weitere Mutationen an.
Doch im Gegensatz zur den Parallelen während der frühen Entwicklung der Glioblastome teilen die wiedergekehrten Tumoren keine charakteristisch übereinstimmenden Mutationen. Sie können aus Krebszellen mit einer Vielzahl verschiedener Mutationsmuster hervorgehen. „Das deutet darauf hin, dass die derzeitige Standardtherapie keinen spürbaren Selektionsdruck auf die Krebszellen ausübt, also auch nicht die Entstehung resistenter Subklone fördert. Das zeigt, dass wir grundsätzlich neuartige Behandlungsformen brauchen, um Glioblastome wirksam behandeln zu können", resümiert Peter Lichter die aktuellen Ergebnisse.
Quelle: Deutsches Krebsforschungszentrum (DKFZ)
22.03.2019