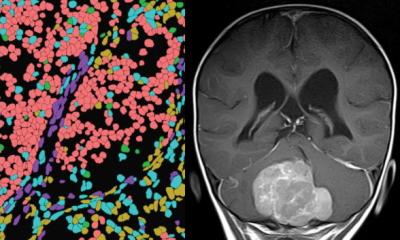
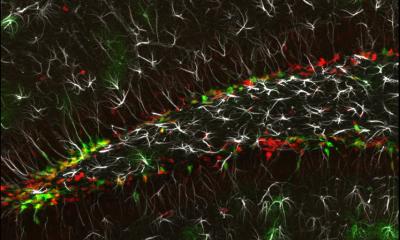
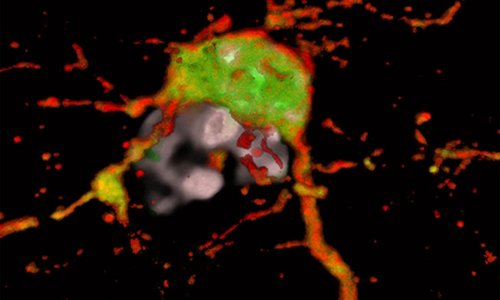
Bildquelle: Foerster LC, Kaya O, Wüst V et al., Nature Communications 2025 (CC BY 4.0)
News • Unterbrechung von Aktivierungspyramiden
Glioblastom-Forschung: Hirntumore in Dauerschlaf versetzen
Jeder Hirntumor ist aus Zellen in aufeinander abfolgenden Aktivierungsstadien aufgebaut. Forschende vom Deutschen Krebsforschungszentrum (DKFZ) und der Universität Heidelberg haben nun bei bösartigen Hirntumoren erstmals den individuellen Aufbau dieser Aktivierungs-Pyramiden analysiert.
Dabei stießen sie auf ein Signalprotein, das den Übergang vom ruhenden zum aktivierten Zustand verlangsamt, indem es die Krebszellen epigenetisch umprogrammiert. Die Hoffnung ist, Krebszellen damit dauerhaft in einem Ruhezustand einzufrieren und damit das Tumorwachstum aufzuhalten.
Die Wissenschaftler veröffentlichten ihre Erkenntnisse im Fachjournal Nature Communications.
Unsere Ergebnisse bestätigen, dass nicht alleinentscheidend ist, aktive Krebszellen zu töten, sondern dass vor allem die Blockade der Übergänge zwischen Aktivität und Ruhezustand für den Ausgang einer Therapie entscheidend ist
Ana Martin-Villalba
Das Glioblastom ist die häufigste und aggressivste Form von Hirntumoren im Erwachsenenalter. Trotz Operation, Bestrahlung und Chemotherapie kehren die Tumoren nach der Behandlung in der Regel innerhalb weniger Monate zurück. Wie bei vielen anderen Krebsarten wird auch beim Glioblastom das Wachstum durch Krebsstammzellen angetrieben, aus denen Tumorzellen in verschiedenen ineinander übergehenden Aktivierungsstadien hervorgehen. „Man kann sich die Zusammensetzung der Glioblastom-Zellen wie eine Pyramide vorstellen: Die ruhenden Zellen bilden die Basis, dann folgen die zur Teilung aktivierten, und an der Spitze stehen die so genannten differenzierten Tumorzellen, die tatsächlich einige Merkmale von Nervenzellen haben“, erklärt Studienleiterin Ana Martin-Villalba vom DKFZ.
Viele Krebstherapien sind nicht nachhaltig, weil sie sich z.B. gegen die teilungsaktiven Tumorzellen richten, deren Verluste aber schnell aus der Population der ruhenden Zellen an der Basis der Pyramide wieder aufgefüllt werden. „Deswegen ist es wichtig zu verstehen, welcher molekulare Signalweg für den Übergang zwischen diesen beiden Aktivitätszuständen verantwortlich ist. Dann kann man gezielt nach einer medikamentösen Blockade dafür suchen“, so die Wissenschaftlerin. Doch diese molekularen Wege sowie die Dynamik, mit der die verschiedenen Aktivierungszustände ineinander übergehen, sind ein bislang wenig beachteter Aspekt der Tumorbiologie.
Das ändert sich nun mit der aktuellen Arbeit des Teams um Martin-Villalba. Die Heidelberger Forschenden entwickelten auf der Basis vom Einzelzell-mRNA-Sequenzierung ein innovatives Analyseverfahren, mit dem sie erstmals die Aktivierungszustände von Glioblastom-Zellen systematisch kartieren konnten. Dafür verglichen sie die molekularen Profile der Tumorzellen von 55 Glioblastompatienten mit denen gesunder neuronaler Stammzellen aus dem Gehirn der Maus. „Damit haben wir erstmals für jeden Patienten den individuellen Aufbau der Pyramide bestimmt – ein bislang unterschätzter Aspekt der Tumorbiologie“, erklärt Leo Carl Foerster, einer der beiden Erstautoren der Studie.
Ein zentrales Ergebnis: Je höher der Anteil ruhender Tumorzellen an der Pyramidenbasis, desto langsamer wächst das Glioblastom – und desto besser ist die Prognose für Betroffene. Durch den Vergleich der Genexpressionsdynamik in gesunden Zellen und Tumorzellen entdeckte das Team, dass beim Übergang vom ruhenden zum aktivierten Zustand die Expression des Signalproteins SFRP1 fehlgesteuert ist. SFRP1 hemmt den wichtigen Wnt-Signalweg, der unter anderem für die Aktivierung von Stammzellen wichtig ist. In Mausmodellen konnte eine Überexpression von SFRP1 das Tumorwachstum signifikant verlangsamen. „Durch SFRP1 konnten wir die menschlichen Tumorzellen in einen Schlafmodus versetzen. Das bremst nicht nur ihr Wachstum, sondern verlängert auch deutlich das Überleben der Mäuse“, berichtet Oguzhan Kaya, ebenfalls Erstautor.
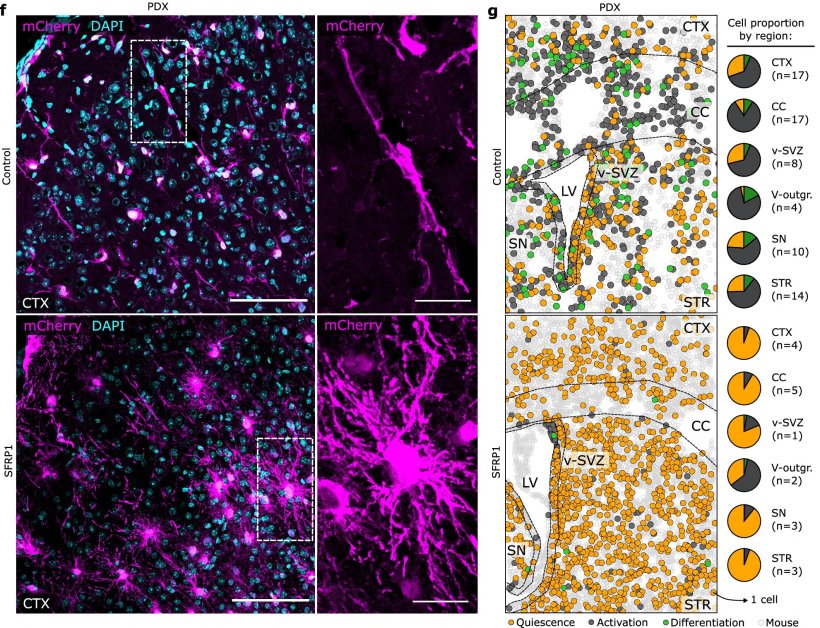
Bildquelle: Foerster LC, Kaya O, Wüst V et al., Nature Communications 2025 (CC BY 4.0)
Unter dem Einfluss von SFRP1 änderten die Tumorzellen nicht nur ihre Aktivität, sondern auch ihr epigenetisches Profil – also das „Gedächtnis“ ihrer Zellidentität. Sie entwickelten Merkmale von reifen Astrozyten, also Hirnzellen, die keine Teilungsfähigkeit mehr besitzen. Diese epigenetische Reprogrammierung könnte künftig möglicherweise helfen, die Rückkehr der Tumoren zu verhindern: Die epigenetischen Methyl-Markierungen am Erbgut schränken die zelluläre Wandlungsfähigkeit ein, indem sie das Genom auf die spezifischen Funktionen differenzierter Zellen beschränkt. Die Forschenden fanden außerdem, dass eine Bestimmung des epigenetischen Methylprofils die Zusammensetzung der individuellen Aktivierungs-Pyramide jedes Tumors abbildet und so für eine Stratifizierung der Patienten genutzt werden kann.
In zukünftigen Arbeiten will das Heidelberger Team prüfen, ob die SFRP1-vermittelte Umgestaltung der Methylierung Glioblastomzellen dauerhaft in einem Ruhezustand „einfrieren“ kann. Das könnte einen potenziellen Therapieansatz gegen bisher kaum kontrollierbare Erkrankungen wie das Glioblastom eröffnen. „Unsere Ergebnisse bestätigen, dass nicht alleinentscheidend ist, aktive Krebszellen zu töten, sondern dass vor allem die Blockade der Übergänge zwischen Aktivität und Ruhezustand für den Ausgang einer Therapie entscheidend ist“, resümiert Ana Martin-Villalba die Ergebnisse der Arbeit.
Quelle: Deutsches Krebsforschungszentrum
15.08.2025