Artikel • Therapiemonitoring
Wettlauf: Liquid Biopsy versus Radiomics
Die Entwicklung neuer Verfahren für präzises Therapiemonitoring in der Onkologie nimmt Fahrt auf. Die sogenannte Liquid Biopsy (Flüssigbiopsie) ist eines davon.
Interview: Daniela Zimmermann
Dank dieser neuen Labortechnik kann anhand einer Blutprobe nichtinvasiv freie Tumor-DNA identifiziert, charakterisiert und überwacht werden. Die Liquid Biopsy hat das Potenzial, die onkologische Diagnostik zu revolutionieren – und der Radiologie einen Dämpfer zu versetzen. Es ist Zeit zu handeln, fordert daher Prof. Dr. Jens Ricke, Inhaber des Lehrstuhls für Radiologie an der Ludwig-Maximilians-Universität München und Direktor der Klinik und Poliklinik für Radiologie am Klinikum der LMU. Denn die Radiologie hat echte Asse im Ärmel, sollten Analyseverfahren wie Radiomics schnell genug den Kinderschuhen entwachsen.
Was begründet den Erfolg der Liquid Biopsy?

Sobald die Tumor-DNA durch Liquid Biopsy identifiziert wurde, können in der Regel auch genetische Mutationen determiniert werden, die möglicherweise die Therapie entscheidend beeinflussen. Dieser Effekt zeigt sich beispielsweise bei der personalisierten Therapie des kolorektalen Karzinoms. Eine RAS- oder RAF-Mutation des metastasierenden Dickdarmkrebses verändert beispielsweise die Systemtherapie entscheidend und kann tatsächlich in der im Blut zirkulierenden Tumor-DNA via Liquid Biopsy nachgewiesen werden.
Wo bleibt da die Bildgebung?
Es gibt bereits besser geeignete Parameter, ihnen fehlen jedoch die klinische Validierung
Jens Ricke
Das ist der wunde Punkt. Methoden wie die Liquid Biopsy sind reine Laborverfahren, die erst in den letzten Jahren auf den Markt gekommen sind oder sich gerade in der Entwicklung befinden. Dieser Prozess ist noch lange nicht abgeschlossen, aber wir müssen jetzt aktiv werden und die Zukunft der radiologischen Bildgebung in der Onkologie aktiv gestalten. Denn sollte die Liquid Biopsy halten, was sie verspricht, könnte sie erfolgreich einen Teil der engmaschigen Kontrolle via Bildgebung in der Onkologie ersetzen. Natürlich werden Radiologen dadurch nicht arbeitslos, aber wir sollten uns jetzt mit der Zukunft auseinandersetzen und vor allem das noch ungenutzte Potenzial in der Bildgebung heben. So haben wir sehr lange mit RECIST-Kriterien (Response Evaluation Criteria in Solid Tumors) gelebt und deren Ungenauigkeiten in Kauf genommen. Wir brauchen jedoch klare Maßstäbe. Denn die derzeit etablierte reine Größenmessung, also der Nachweis, ob ein Tumor auch nur geringfügig wächst oder schrumpft, kann häufig nicht aussagekräftig genug bestimmen, ob ein Therapieansprechen vorliegt oder nicht. Es gibt bereits besser geeignete Parameter, ihnen fehlen jedoch die klinische Validierung und damit die Eignung als Nachsorgevariablen.
Hier kommt Radiomics ins Spiel: Entwicklungen, die daraus entstehen, sind absehbar auch für eine Verwendung als Ansprechkriterien onkologischer Therapien geeignet. Es fehlt jedoch der Beweis, dass die Parametrisierung tatsächlich das mit dem Therapieansprechen verbundene längere Überleben des Patienten vorhersagt. Diese Daten liegen momentan nur fragmentarisch vor und es wird viele Jahre dauern, sie zu analysieren und erfolgreich in Kriterien umzusetzen, deshalb ist Eile geboten. Die Konkurrenz schläft nicht, deshalb sollten wir mehr Ressourcen in dieses Feld investieren, denn ich glaube, wir haben die Mittel und Möglichkeiten, sinnvolle Alternativen zu schaffen.
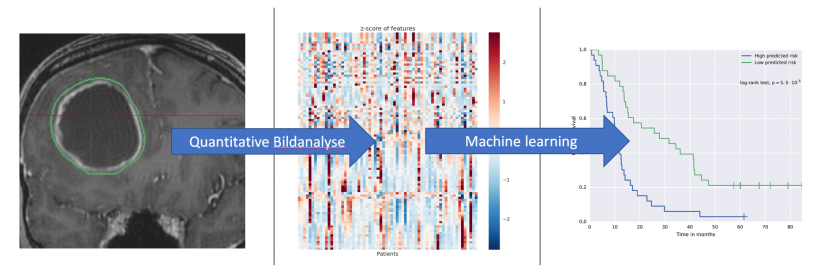
Welche konkreten Schritte müssen unternommen werden, um diese Zukunft zu gestalten?
Wir brauchen vor allem Validierungsstudien. Es beginnt mit den entsprechenden Bildgebungsmethoden, die völlig neue Analyseformen umfassen können. Die Essenz von Radiomics ist, aus Bilddaten mehr Informationen zu deduzieren als das Auge erfassen kann. Es handelt sich um aufwändige statistische Analysen – das Schlagwort dafür ist Big Data – die auf eine große Fleißarbeit hinauslaufen. Denn ein umfangreicher Datensatz muss so lange analysiert werden, bis Muster erkennbar sind, die Vorhersagewerte für ein vorhandenes oder nicht vorhandenes Therapieansprechen liefern. Erste Hinweise auf erfolgreiche Verfahren gibt es bereits, die aus dem Bereich des MRT stammen. Dabei wird es jedoch nicht bleiben. Umso wichtiger ist es, vielversprechende Methoden auch zu validieren. Prospektive, klinische Studien, die neuartige Bildgebungs-Endpunkte für das Therapieansprechen beinhalten und im Ergebnis darstellen, sind unverzichtbar. Eine Zulassungsstudie für ein Pharmakon läuft heute immer noch nach RECIST-Kriterien, das verlangen schon die FDA oder EMA, aber es müssten parallel potentielle neue Bildgebungsendpunkte validiert werden.
Wie schnell können Ergebnisse vorliegen?
Die Validierung solcher Verfahren ist sehr zeitaufwändig. Deshalb müssen diese Projekte so schnell wie möglich gestartet werden. Die Validierung erfolgt immer endpunktbezogen für die Gesamtstudie, also gerne auch durch Überlebensstudien mit langjährigem Verlauf. Zum einen dauern diese an sich viele Jahre, zum anderen kann sich die Zeitspanne bis zum Start einer solchen Studie ebenfalls über mehrere Jahre erstrecken.
Gibt es politische oder industrielle Unterstützung für diese Methoden?
Studien dieser Art sind öffentlich förderungswürdig. Interessanter als öffentliche Förderung ist in diesem Fall eine Adaptation durch die Pharmaindustrie. Für die Validierung werden klinische Studien benötigt, zu deren Inhalten neue bildgebende Qualitäten addiert werden müssten. Diese Art von Studien sind im öffentlichen Raum unterrepräsentiert. Das Bewusstsein in der Pharmaindustrie für die Notwendigkeit neuer Bildgebungsendpunkte ist übrigens mit dem Erfolg der Immuntherapien deutlich gestiegen. Denn bei dieser Therapieform ist in der initialen Phase oft ein Therapieansprechen im klassischen Sinne nicht sichtbar. Ganz im Gegenteil: Tumoren werden manchmal trotz Ansprechen zunächst größer – im Wesentlichen zurückzuführen auf eine lymphozytäre Infiltration, also eine entzündliche Begleitreaktion der Immuntherapie. Diese generiert eine Pseudoprogression, was zur Folge hat, dass ein klassisch geschulter Radiologe oder Onkologe das Wachstum als Rückschlag wertet und das Präparat absetzt. In einer Vielzahl von Fällen folgt auf die Vergrößerung des Tumors bei Immuntherapie aber eine Verkleinerung, die Therapie hätte also nur der Fortsetzung bedurft.
Um diesen Gegebenheiten trotzdem Rechnung zu tragen, wurden die RECIST-Kriterien um die sogenannten iRECIST-Kriterien erweitert, die bei Immuntherapien eine spezielle Evaluation des Therapieerfolges empfehlen. Wird Tumorwachstum festgestellt, erfolgt kurzfristig eine weitere Kontrolle, um zu überprüfen, ob eine tatsächliche Progression oder eben doch eine Remission vorliegt. Offensichtlich bestehen in der onkologischen Gemeinde hieran Zweifel, so dass Immuntherapeutika in der klinischen Routine durchaus früher abgesetzt werden als in den Zulassungsstudien – mit Verlusten für die Patienten, weil das erfolgreiche Medikament fälschlich abgesetzt wird, aber eben auch für das Pharmaunternehmen, weil der Verkauf zurückgeht. Deshalb haben sowohl die Pharmaindustrie als auch Patienten, Onkologen und Radiologen ein gemeinsames Interesse daran, neue und bessere Bildgebungs-Endpunkte zu entwickeln. Wir sollten unsere Chancen dazu nutzen.
Profil:
Prof. Dr. Jens Ricke, Facharzt für Radiologie, habilitierte an der Charité, Universitätsmedizin Berlin. Dort hatte er zwischen 2004 und 2006 eine C3-Professur für Interventionelle Radiologie an der Klinik für Strahlenheilkunde inne. Von 2006 bis 2017 war Ricke Lehrstuhlinhaber Radiologie an der Otto-von-Guericke-Universität Magdeburg sowie Direktor der Klinik für Radiologie und Nuklearmedizin am Universitätsklinikum Magdeburg. Im Juni 2017 wechselte er an die Ludwig-Maximilians-Universität München, wo er den Lehrstuhl für Radiologie innehat und als Direktor der Klinik und Poliklinik für Radiologie tätig ist.
Veranstaltung:
Donnerstag, 18.01.2018,
09:35-10:00 Uhr
Zukunft der radiologischen Response-Kriterien in Zeiten der Liquid Biopsy
Jens Ricke, D-München
Session: Innovationskraft CT: Früherkennung. Diagnose. Therapie
15.01.2018