Wenn Tumoren blinken
Oder: die leuchtende Zukunft für die molekulare Bildgebung in der Onkologie
Mit dem Aufkommen von Hybridtechnologien wie PET-CT und MR/PET hat ein neues Zeitalter in der klinischen Diagnostik begonnen. Kaum ein anderes Forschungsfeld spiegelt das Streben nach einer personalisierten Medizin so sehr wider wie die molekulare Bildgebung.
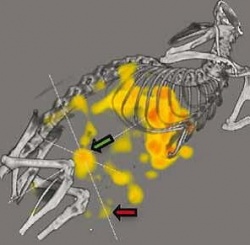
Gerade in der Onkologie gehört die Nuklearmedizin schon zum festen klinischen Repertoire. Sie hilft dabei, Tumoreigenschaften zu charakterisieren und dadurch Krebspatienten den richtigen Therapien zuzuführen. Welche Evolutionssprünge von der molekularen Bildgebung in Zukunft zu erwarten sind, berichtet Univ.-Prof. Dr. Fabian Kießling, Leiter des Lehrstuhls für Experimentelle Molekulare Bildgebung am Universitätsklinikum Aachen.
Prof. Kießling, welche bildgebenden Hoffnungsträger befinden sich gerade in der Erprobung?
Fabian Kießling: Es gibt ein paar sehr spannende Neuerungen, wie die Tscherenkow-Bildgebung und das Magnetic Particle Imaging, über deren Bedeutung wir allerdings erst in zehn Jahren eine klare Aussage treffen können. Was sicherlich großes Potenzial hat, ist die fotoakustische Bildgebung. Dabei führt absorbiertes Licht zu einer lokalen Erwärmung von Molekülen im Gewebe, die sich ausdehnen und gleichzeitig einen kurzen Schall senden, der mit einem Ultraschallgerät aufgefangen wird. Gegenüber der optischen Bildgebung liegen die Vorteile dieses Verfahrens in der verbesserten Tiefenauflösung, sodass eine qualitativ präzisere Aussagekraft erreicht wird.
Welche Chancen geben Sie der optischen Bildgebung?
Die ist stark im Kommen. Vor allem in der Endoskopie, der Bronchoskopie, der intraoperativen Diagnostik, bei Halstumoren, Augenuntersuchungen und vielleicht auch in der Mammadiagnostik. Eben überall dort, wo die benötigte Eindringtiefe relativ gering ist. Für die optische Bildgebung kann man im Prinzip auch sehr kleine Kontrastmittel entwickeln, die sehr sensitiv und nebenwirkungsarm sind. Eine Studie in „Nature Medicine“ (van Dam, Ntziachristos et. al, 2011, Bd. 52) hat gezeigt, dass die intraoperative optische Bildgebung mehr Metastasen aufspürt als die Standardlichtobservation. Dadurch könnte das Patienten-Outcome signifikant verbessert werden.
Welches Verfahren unter den Forschungsexoten erscheint Ihnen am vielversprechendsten?
Mir gefällt der Cell-Tracking-Ansatz, der sowohl bei der nuklearmedizinischen Bildgebung als auch mit der MRT schon gute Erfolge zeitigt. Möglicherweise bekommen zelluläre Therapien, sei es durch dendritische Zellen oder T-Zellen, in der Tumorbekämpfung in Zukunft mehr Bedeutung. Vor allem wenn man bedenkt, dass das Tumorgeschehen hauptsächlich ein Ungleichgewicht des Immunsystems darstellt. Denn sonst kann ein Tumor nicht wachsen. Man könnte sich also vorstellen, dass Therapien künftig darauf basieren, das Immunsystem wieder umzupolen. Vielleicht werden auch vorpolarisierte Zellen gespritzt, die den Tumor selektiv vernichten und das Immunsystem quasi dazu zwingen, den Tumor zu erkennen. Da ist künftig Musik drin, erste klinische Studien einer holländischen Gruppe gibt es dazu bereits.
Wie steht es mit der molekularen Ultraschalldiagnostik?
Das erste molekulare Kontrastmittel mit targetspezifischen Mikrobläschen befindet sich zurzeit in der klinischen Erprobung. Es bindet an den VEGFR-2-Rezeptor und wird verwendet, um Prostatakarzinome zu charakterisieren. In Aachen haben wir dieses Kontrastmittel auch intensiv präklinisch beim Mammakarzinom getestet. Dabei konnten wir eine sehr viel bessere Differenzierung von benignen und malignen Tumoren über VEGFR-2 im Vergleich zu funktionellen Parametern wie relatives Blutvolumen oder Perfusion feststellen. In anderen Worten: Hier lässt sich ein diagnostischer Mehrwert über ein sehr kostengünstiges und einfaches Verfahren gewinnen, das zudem sehr nebenwirkungsarm ist. Vorstellbar wären auch Targets für entzündliche Veränderungen. Daran arbeiten unter anderem zurzeit eine Forschergruppe aus Stanford und unser Institut. Sowohl für inflammatorische Tumorerkrankungen als auch für kardiovaskuläre Charakterisierungen wäre das durchaus interessant.
Wie sieht es mit der Weiterentwicklung von Tracern und Chemotherapeutika aus?
Das Portfolio an Tracern insbesondere für PET nimmt zu. Neben 18F-FDG wurden in letzter Zeit weitere Marker zugelassen, zum Beispiel 18F-Cholin für die Prostatadiagnostik in einigen Zentren in den USA. Was die Chemotherapeutika angeht, so zeigen sie bisher noch sehr unangenehme Nebenwirkungen. Unser Ziel ist es, die Größe der Mittel zu optimieren, sodass das Medikament nur dort austritt, wo die Gefäße porös sind. Das sind typischerweise auch die Stellen, wo der Tumor sitzt. Dazu werden Nanosubstanzen markiert und anschließend untersucht. Das ist zwar noch im Forschungsstadium, könnte aber zukünftig die personalisierten Therapien weiter voranbringen.
IM PROFIL
Univ.-Prof. Dr. Fabian Kießling folgte 2008 dem Ruf der RWTH Aachen für eine W3-Universitätsprofessur auf den Lehrstuhl für Experimentelle Molekulare Bildgebung an der RWTH Aachen. Der 40-Jährige war langjähriger Sprecher der Arbeitsgruppe Methodik und Forschung der Deutschen Röntgengesellschaft (DRG) und ist Chairman des Molecular Imaging Subcommittees der European Society for Radiology (ESR). Ferner war er bereits mehrfach Mitglied der Programmkomitees für die Kongresse der European Society for Molecular Imaging (ESMI) und der World Society for Molecular Imaging (WMIS). Er ist Gründungsmitglied der European Society for Molecular and Functional Imaging in Radiology (ESMOFIR) und seit 2012 im Council der European Society for Molecular Imaging (ESMI).
29.05.2013