Quelle: Katja Buder, Nanobiotechnologie-Gruppe, Department Chemie
News • In Hydrogel eingebettet
Goldnanopartikel werden unter Haut implantiert
Winzig kleine Goldnanopartikel können als medizinische Sensoren unter die Haut implantiert werden und von hier Informationen über Körperfunktionen oder im Blut zirkulierende Stoffe nach außen übermitteln.
Das grundlegende Prinzip dieser Beobachtung von Biomarkern mithilfe von Nanogold hat die Nanobiotechnologie-Gruppe von Prof. Dr. Carsten Sönnichsen an der Johannes Gutenberg-Universität Mainz (JGU) demonstriert. Nun ist es dem Team gelungen, eine geeignete Verpackung für die Nanoteilchen zu finden. "Die winzigen Sensoren müssen in ein Gel eingebettet werden, damit sie ihre Funktion erfüllen und gut zu handhaben sind", sagt Katja Buder aus der Arbeitsgruppe um Sönnichsen. "An dieses Gel stellen wir einige Bedingungen, es ist noch weit mehr als eine reine Verpackung. Jetzt haben wir unter vier Kandidaten die beste Verbindung herausgefunden." Sehr gut geeignet ist demnach ein Hydrogel, das aus zwei Polymeren besteht und abgekürzt als pHEMA-PEGDA bezeichnet wird.
Quelle: Bastian Flietel, Nanobiotechnologie-Gruppe, Department Chemie
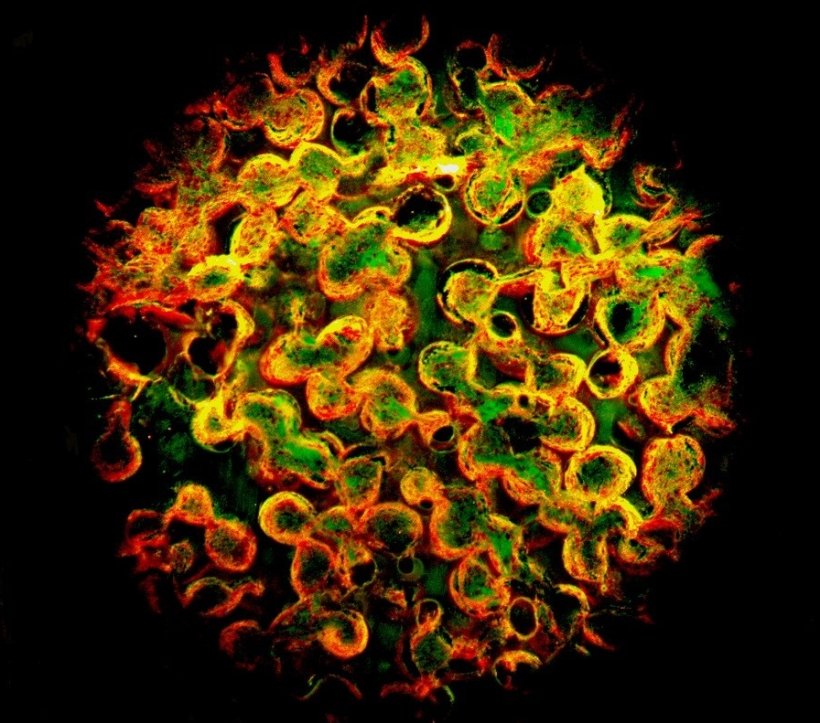
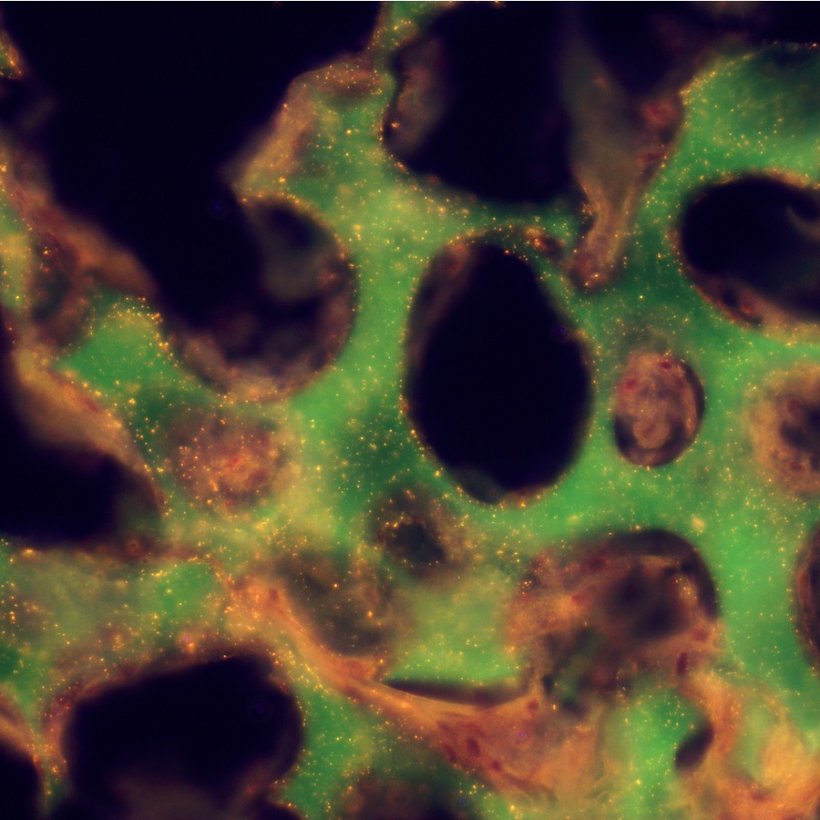
Hydrogel besitzt gewebeähnliche Struktur mit verbundenen Poren
Mit implantierbaren Sensoren können Biomarker für medizinische Zwecke kontinuierlich überwacht werden, ohne dass Blutproben entnommen werden müssen. Für die Lebensqualität beispielsweise von Diabetikern würde diese Datenübertragung eine deutliche Verbesserung bedeuten. Die Gruppe um Carsten Sönnichsen hatte in den vergangenen Jahren solche Nanosensoren entwickelt und gezeigt, dass durch Kontakt mit einem Antibiotikum eine Farbveränderung des Sensors erfolgt, die durch die Haut ausgelesen werden kann. Die Nanopartikel müssen dazu in ein gewebeähnliches Hydrogel eingebettet werden, das große, miteinander verbundene Poren besitzt. Durch diese Poren können kleine Blutgefäße oder Zellen einwachsen, die zum einen den zu analysierenden Stoff zu den Sensoren transportieren und zum anderen das Implantat an Ort und Stelle halten. "Aber am wichtigsten ist, dass die Funktion der Nanosensoren in dieser Hydrogelmatrix erhalten bleibt", sagt Katja Buder, die sich mit den unterschiedlichen Gelen im Rahmen ihrer Doktorarbeit beschäftigt.
Dieser Artikel könnte Sie auch interessieren
News • Implantierbarer Sensor
Tattoo aus Nanogold soll Diagnostik verbessern
Ein Forschungsteam der Johannes Gutenberg-Universität Mainz (JGU) hat einen neuartigen implantierbaren Sensor entwickelt, der mehrere Monate im Körper verwendet werden kann. Grundlage dafür sind farbstabile Goldnanopartikel, die mit Rezeptoren für bestimmte Moleküle versehen werden. Eingebettet in eine Art künstliches Gewebe aus Polymeren wird das Nanogold unter die Haut implantiert, wo es…
Porenstruktur reguliert Durchlässigkeit des Gels
Getestet wurden vier Kandidaten: Agarose, das ist ein Polysaccharid auf Algenbasis, zwei Copolymere, nämlich pHEMA-TEGDMA und pHEMA-PEGDA, sowie das Polymer pPEGDA. "Die Stoffe müssen einerseits biologisch verträglich sein, damit sie im Körper keinen Schaden anrichten, andererseits dürfen sie nicht biologisch abbaubar sein", so Buder. Das ist noch nicht alles: Das Gel soll vom Köper nicht als Fremdstoff erkannt werden, weil es sonst eingekapselt würde. Dies gelingt durch die Porenstruktur. Dabei sorgen zwei Arten von Poren in zwei Größenskalen für die richtige Mischung: Makroporen im Mikrometerbereich erlauben das Einwachsen von Blutgefäßen und Zellen, während Mikroporen im Nanometerbereich unerwünschte Proteine am Eindringen hindern. "Die Copolymere funktionieren am besten. Die beiden Polymerstränge sind miteinander verknüpft und bilden eine Art Maschenstruktur, die unsere Nanosensoren wie ein Schutzschild umgibt und unerwünschte Eindringlinge abhält", sagt Katja Buder.
Der eigentliche Sensor, der wie eine Antenne funktioniert, besteht aus Milliarden von winzigen Goldnanopartikeln. Auf jedem dieser Nanoteilchen sitzen wiederum eine Menge kleiner DNA-Stränge, an die sich die zu untersuchende Substanz anheftet. Das Gel hat die Aufgabe, die zahllosen Partikel einzubetten, die Funktion der Partikel zu erhalten und das Konglomerat in der Größe von einem Cent-Stück in eine passende Form und Konsistenz zu bringen: Es soll weich und angenehm unter der Haut sein, aber auch nicht zu weich, damit es mit einer Pinzette gut zu handhaben ist. Diese Anforderungen hat pHEMA-PEGDA – die Abkürzung steht für ein Copolymer aus Poly(2-hydroxyethyl methacrylatpoly(ethylen glycol)diacrylat) – am besten erfüllt. "Mit pHEMA-PEGDA haben wir das passende Gel gefunden, das wir auch bei künftigen Versuchen einsetzen werden", erklärt Katja Buder.
Die Arbeit wurdein Applied Bio Materials veröffentlicht.
Quelle: Johannes Gutenberg-Universität Mainz
07.04.2022





