News • Implantierbarer Sensor
Tattoo aus Nanogold soll Diagnostik verbessern
Die Idee von implantierbaren Sensoren, die kontinuierlich Informationen über Vitalwerte oder Konzentrationen von medizinisch relevanten Stoffen und Medikamenten im Körper liefern, fasziniert Ärzte und Wissenschaftler seit Langem. Denn so können sie Krankheitsverläufe und Therapieerfolge ständig beobachten.
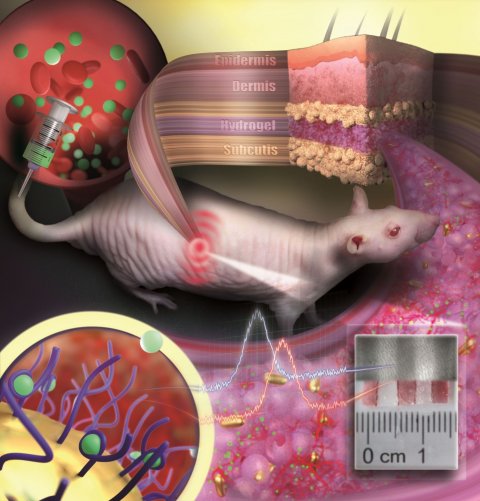
Abbildung: Nanobiotechnologie-Gruppe, Department Chemie
Allerdings können solche Sensoren bisher noch nicht dauerhaft im Körper verbleiben, sondern müssen spätestens nach wenigen Tagen oder Wochen ausgetauscht werden. Zum einen erkennt der Körper das Implantat als fremd und stößt es ab. Zum anderen verblasst mit der Zeit die Farbe, die als Indikator für Konzentrationsänderungen eines bestimmten Stoffes dient. Ein Forschungsteam der Johannes Gutenberg-Universität Mainz (JGU) hat einen neuartigen implantierbaren Sensor entwickelt, der mehrere Monate im Körper verwendet werden kann. Grundlage dafür sind farbstabile Goldnanopartikel, die mit Rezeptoren für bestimmte Moleküle versehen werden. Eingebettet in eine Art künstliches Gewebe aus Polymeren wird das Nanogold unter die Haut implantiert, wo es als Reaktion auf Konzentrationsänderungen eines Arzneistoffes die Farbe wechselt.
Die Wissenschaftler veröffentlichten ihre Erkenntnisse jetzt im Fachjournal Nano Letters.
Die Arbeitsgruppe um Prof. Dr. Carsten Sönnichsen nutzt bereits seit Jahren einzelne Goldnanopartikel als Sensoren zum Nachweis kleinster Proteinmengen in mikroskopischen Flusszellen. Goldnanopartikel wirken wie Antennen für Licht: Sie streuen und absorbieren es und sind deswegen farbig. Auf Änderungen in ihrer Umgebung reagieren sie mit Farbänderungen. Dieses Konzept hat sich das Forschungsteam um Sönnichsen für die implantierte Sensorik zunutze gemacht. Damit die winzigen Nanopartikel im Körper nicht einfach wegschwimmen oder von Immunzellen abtransportiert werden, haben die Forscher sie in ein poröses Hydrogel mit gewebeähnlicher Konsistenz eingebettet. Unter die Haut implantiert wachsen kleine Blutgefäße und Zellen in die Poren ein. Das Implantat wird in das Gewebe integriert, eine Fremdkörperabstoßung durch den Organismus verhindert. "Unseren Sensor kann man sich wie ein unsichtbares Tattoo vorstellen, nicht viel größer als ein Cent-Stück und dünner als ein Millimeter", so Projektleiter Sönnichsen. Da die Goldnanopartikel infrarot sind, kann unser Auge die Farbe nicht wahrnehmen. Mit einem speziellen Messgerät kann das Implantat aber nicht-invasiv durch die Haut sichtbar gemacht werden.
Von farbigen Objekten sind wir es gewohnt, dass sie mit der Zeit ausbleichen. Bei Goldnanopartikeln passiert das nicht, sie behalten dauerhaft ihre Farbe
Katharina Käfer
In der neuen Studie hat das Forschungsteam der JGU die Farbänderung des Sensors nach Verabreichung verschiedener Dosen eines Antibiotikums in haarlosen Ratten beobachtet. Über die Blutbahn werden die Arzneistoffmoleküle zum Implantat transportiert. Dort induzieren sie die Farbänderung, sobald sie von spezifischen Rezeptoren auf der Oberfläche der Goldnanopartikel gebunden werden. Die Kombination der farbstabilen Goldpartikel mit dem einwachsenden Hydrogel führt dazu, dass der Sensor im Körper über mehrere Monate mechanisch und optisch stabil bleibt. "Von farbigen Objekten sind wir es gewohnt, dass sie mit der Zeit ausbleichen. Bei Goldnanopartikeln passiert das nicht, sie behalten dauerhaft ihre Farbe. Weil sie relativ einfach mit verschiedenen Rezeptoren beschichtet werden können, eignen sie sich sehr gut als Plattform für implantierbare Sensoren", erklärt Dr. Katharina Käfer, Erstautorin der Studie.
Das neue Konzept ist generalisierbar und hat das Potenzial, die Lebensdauer von implantierbaren Sensoren deutlich zu verlängern. In Zukunft könnten mit Goldnanopartikel-basierten Implantaten die Konzentrationen verschiedener Biomarker oder Medikamente im Körper gleichzeitig verfolgt werden. Denkbar ist der Einsatz in der Arzneistoffentwicklung, der medizinischen Forschung oder der personalisierten Medizin, beispielsweise zur Therapie chronischer Erkrankungen.
Quelle: Johannes Gutenberg-Universität Mainz
01.04.2021





