Quelle: Heikenwälder/DKFZ
News • Biologischer Mechanismus entschlüsselt
Wie Zellen des Lymphdrüsenkrebs Absiedlungen im Gehirn bilden können
Lymphdrüsenkrebs im zentralen Nervensystem ist selten, aber gefährlich. Wissenschaftler im Deutschen Krebsforschungszentrum (DKFZ) haben jetzt herausgefunden, welche molekularen Mechanismen zu Absiedlungen der Lymphome ins zentrale Nervensystem führen. Die Forscher zeigten an Mäusen, dass chronische Entzündungsprozesse im alternden Gehirn eingewanderte Lymphomzellen im Gehirngewebe zurückhalten, statt sie direkt wieder ins Blut zu entlassen. Schlüsselmoleküle dieses Mechanismus identifizierten die Forscher auch in Gewebeproben von Patienten mit Lymphomen des zentralen Nervensystems. Daher hoffen sie, einen möglichen Schlüssel für die Entwicklung einer präventiven Therapie in der Hand zu halten.
Lymphome des zentralen Nervensystems (ZNS-Lymphome) sind eine seltene und sehr aggressive Form von Lymphdrüsenkrebs. Insbesondere Patienten mit sekundären ZNS-Lymphomen haben eine schlechte Prognose. Bei dieser Form handelt es sich um Absiedlungen von Lymphomen, die zuerst an anderen Körperstellen aufgetreten sind, etwa in der Milz. Wie es dazu kommt, dass Lymphomzellen ins Gehirn einwandern und sich dort einnisten, war bisher weitgehend ungeklärt. „Wir konnten jetzt nachweisen, dass Entzündungsvorgänge im Gehirn dabei eine zentrale Rolle spielen", sagt Mathias Heikenwälder vom DKFZ. Gemeinsam mit Kollegen vom Helmholtz Zentrum München und von der TU München ist es dem DKFZ-Forscher und seinem Team gelungen, die zugrundeliegenden zellbiologischen Mechanismen zu entschlüsseln.
Ein wichtiger Faktor im Zusammenhang mit chronischen Entzündungen im Gehirn ist NF-kappaB. Dieser Transkriptionsfaktor entscheidet darüber, welche Gene in einer Zelle aktiv sind und spielt für die Regulation der Immunantwort eine wichtige Rolle. Außerdem verdichten sich die Hinweise darauf, dass NF-kappaB und sein Signalweg auch im Zusammenhang mit ZNS-Lymphomen von Bedeutung sind.
Um Entzündungsvorgänge im Gehirn zu untersuchen, züchteten die Forscher genetisch veränderte Mäuse, bei denen NF-kappaB im zentralen Nervensystem permanent aktiv ist. „Diese Tiere entwickeln bereits sehr früh entzündliche Veränderungen im Gehirn. Solche Veränderungen finden wir auch in Gehirngewebe von Lymphompatienten, deren Gewebe wir untersucht haben", erklärt Heikenwälder.
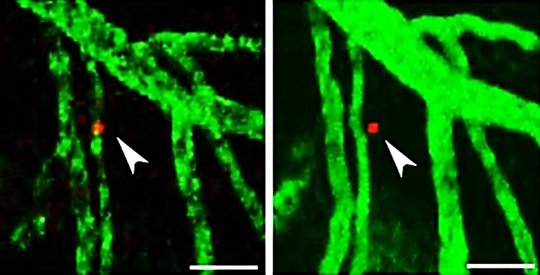
Heikenwälders Team spritzte diesen Tieren nun Lymphomzellen. Und tatsächlich: Die Nager entwickelten Absiedlungen der Lymphome im ZNS. Bei Artgenossen ohne chronische NF-kappaB-Aktivierung war dies nicht der Fall. „Wir haben mit einer speziellen Mikroskopie-Technik beobachtet, dass die Lymphomzellen auch bei normalen Mäusen von den Blutgefäßen ins Gehirn einwandern. Allerdings verbleiben sie bei diesen Tieren nicht im Gehirn, sondern wandern wieder in die peripheren Blutgefäße zurück. Bei den genetisch veränderten Nagern verblieben die eingewanderten Lymphomzellen jedoch im Gehirn. „Interessant war also, was sie dort hält", so Heikenwälder.
Im gesunden, entzündungsfreien Gehirn sorgt ein Botenstoff dafür, dass weiße Blutkörperchen, aber auch Lymphomzellen, vom Gehirngewebe wieder zurück in die Blutgefäße wandern. Die DKFZ-Wissenschaftler konnten jetzt in ihren Experimenten einen wichtigen Gegenspieler dieses Botenstoffs ausmachen: Das Signalmolekül CCL19, dessen Produktion von NF-kappaB angekurbelt wird. „Die beiden Botenstoffe kämpfen quasi um den Verbleib der Lymphomzellen", erläutert Heikenwälder. „Im Fall einer Entzündungssituation mit erhöhter NF-kappaB-Aktivität ist auch mehr CCL19 vorhanden, wodurch es die Oberhand gewinnt und die Lymphomzellen im Gehirn hält." Dort vermehren sie sich und wachsen zu Tumoren heran.
In menschlichen Gehirnen fanden die Wissenschaftler eine ähnliche Situation vor. Bei Menschen mit primären oder sekundären Lymphomen im zentralen Nervensystem ist ebenfalls der NF-kappaB-Signalweg aktiviert und dadurch mehr CCL19 vorhanden. Der Botenstoff wird – genau wie bei den Mäusen – von speziellen Gehirnzellen, den Astrozyten ausgeschüttet. Damit liefern die DKFZ-Forscher nicht nur erstmals eine Erklärung dafür, wie sekundäre ZNS-Lymphome entstehen. „Wir haben entzündliche Gehirnveränderungen als potenziellen Risikofaktor für ZNS-Lymphome identifiziert", sagt Heikenwälder.
Im Experiment hatten sich Lymphomzellen bei älteren Tieren, die nicht genetisch verändert waren, genau so verhalten wie in genetisch veränderten jungen Tieren mit chronischen Entzündungen. „Jetzt kann man darüber nachdenken, ob und wie sich Entzündungssituationen im Gehirn bei Lymphompatienten präventiv behandeln lassen, um sekundäre ZNS-Lymphome zu verhindern."
Source: Deutsches Krebsforschungszentrum
19.09.2019