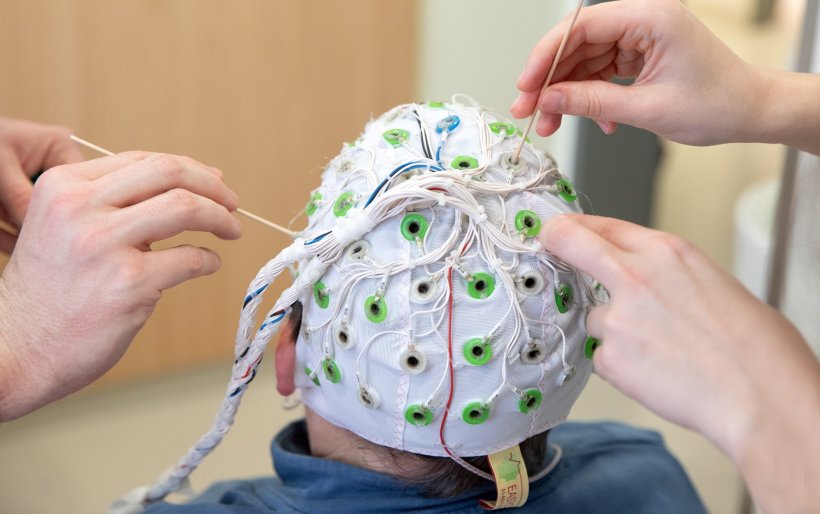
© Karin Kaiser/MHH
News • Anpassung des Gehirns an CI-Hörprothese
Hören mit Cochlea-Implantat: Auf dem Weg zu genauerer Diagnostik
Wenn Hörgeräte kaum oder gar nicht mehr helfen, werden zur Behandlung von Hörverlusten auch sogenannte auditorische Implantate eingesetzt.
Das am weitesten verbreitete ist das Cochlea-Implantat (CI). Allein in Deutschland bietet die Hörprothese etwa 50.000 Menschen, die gehörlos geboren wurden oder im Laufe des Lebens ertaubt sind, den Zugang zur Welt des Hörens. Das CI stimuliert dabei den Hörnerv direkt über implantierte Elektroden in der Hörschnecke (Cochlea) des Innenohrs. Um die neuen Signale zu deuten und als Geräusche, Töne und Sprache wahrnehmen zu können, müssen die Betroffenen ihr Gehirn darauf trainieren.
Wie schnell und wie gut das CI die Hörfähigkeit verbessert, ist jedoch individuell sehr unterschiedlich. Während manche Menschen bereits wenige Stunden nach Einsetzen des CIs Sprache verstehen, brauchen andere Jahre dafür. Obwohl bereits bekannt ist, dass Gehörlose, die erst kürzlich ertaubt sind, meist am schnellsten mit dem Implantat zurechtkommen, sind die genauen Mechanismen, wie sich das Gehirn an das Implantat anpasst, noch in weiten Teilen unbekannt. Das will ein Forschungsteam der Klinik für Nuklearmedizin der Medizinischen Hochschule Hannover (MHH) nun gemeinsam mit dem Deutschen Hörzentrum der MHH und der Universität Oldenburg im Rahmen des Exzellenzclusters Hearing4all aufklären. Die Deutsche Forschungsgemeinschaft (DFG) unterstützt das Projekt mit zusätzlichen Fördermitteln in Höhe von rund einer halbe Million Euro.
Dieser Artikel könnte Sie auch interessieren
News • Elektrische Stimulation des Hörnervs
Forschung für die nächste Generation von Cochlea-Implantaten
Ein Kooperationsprojekt zwischen der TU München und der Medizinischen Universität Innsbruck soll Cochlea-Implantaten einen Entwicklungsschub verschaffen.
Die Qualität der Versorgung mit einem Cochlea-Implantat wird ganz wesentlich daran gemessen, inwieweit die Träger der Hörprothese Sprache verstehen – insbesondere in akustisch schwierigen Situationen mit Hintergrundgeräuschen oder sogar Störfaktoren wie etwa durch Verkehrslärm oder mehrere Sprechende. Dies erfordert eine komplexe Hörverarbeitung, bei der auch Gehirnnetzwerke eine Rolle spielen. „In unserer Studie vergleichen wir die Sprachverarbeitung von CI-Trägern mit unterschiedlich gutem Sprachverstehen“, sagt Projektleiter Professor Dr. Georg Berding, Oberarzt an der Klinik für Nuklearmedizin und Leiter der Arbeitsgruppe „Neuronuklearmedizin“.
Eine der Teilnehmenden ist Karin Raasch. Nach insgesamt vier Hörstürzen hat sie nur noch ein Resthörvermögen von fünf Prozent. Seit 2007 trägt sie ein Cochlea-Implantat. Für die mehrstündige Testung ist Karin Raasch extra aus Köln nach Hannover gereist. „Das mache ich für die Wissenschaft“, erklärt sie und lächelt. Über einen Computer werden Sätze direkt in ihr Implantat eingespielt. Raasch muss per Knopfdruck entscheiden, ob diese einen Sinn ergeben oder nicht. Dann erfolgt eine weitere Testung, bei der zusätzliche Störgeräusche eingespielt werden.
So können wir in Zukunft die Entwicklung therapeutischer Strategien unterstützen, welche die Anpassung an das elektrische Hören gezielt verbessern
Georg Berding
Wie das Hörimplantat das Gehirn der Probandin während der Sprachverarbeitung stimuliert und welche Mechanismen dabei zugrunde liegen, messen die Forschenden simultan mittels Positronen-Emissions-Tomographie (PET) und Elektroenzephalographie (EEG). Während das EEG die Verarbeitung der über das CI empfangenen Signale genau im zeitlichen Verlauf zeigt, ermöglicht die PET die genaue räumliche Zuordnung, wo im Gehirn dies geschieht. Dafür werden minimale Mengen schwach radioaktiver Stoffe eingesetzt, sogenannte Tracer. Karin Raasch erhält über einen Venenzugang Wasser, das einige Wassermoleküle mit dem radioaktiven Sauerstoffisotop 15O enthält, das im MHH-eigenen Teilchenbeschleuniger hergestellt wurde. Mit einer Halbwertzeit von nur zwei Minuten baut dieses sich schnell ab, sodass die Strahlenexposition für die Patientin während der kompletten Untersuchung mit mehreren Tracergaben insgesamt etwa in der Größenordnung einer Röntgen-Computertomographie liegt.
Ein zentraler Aspekt des Projektes ist, die Tracerdosis möglichst weiter zu verringern. „Dafür reduzieren wir die vom PET gelieferten Rohdaten sozusagen künstlich auf eine Datenmenge, wie wir sie bei einer niedrigeren Tracermenge erhalten würden“, sagt Malte Voskamp, wissenschaftlicher Mitarbeiter der Arbeitsgruppe. Daraus entstehen dann unschärfere Bilder, welche mit Hilfe Künstlicher Intelligenz (KI) bearbeitet werden. „Entrauschen“ heißt der Vorgang, bei dem die KI helfen soll, die unschärferen PET-Bilder so umzuwandeln, dass sie dennoch verlässliche diagnostische Informationen bieten – ähnlich wie ein schärferes PET-Bild mit höherer Tracerdosis.
Gelangt der Tracer in die Blutbahn, verteilt er sich im ganzen Körper. „Mit 15O-Wasser können wir daher auch die Durchblutung im Gehirn darstellen“, erklärt Professor Berding. Ist eine Hirnregion besonders aktiv, wird sie intensiver durchblutet und mehr Tracer ist dort vorhanden. Das können die Forschenden dann im Nachhinein auf einem Bildschirm sehen. Welche Regionen im Einzelnen aktiviert sind, ist von Patient zu Patient etwas unterschiedlich. Zudem nutzen ehemals Gehörlose, die mit einer Hörprothese versorgt wurden, für die Hörverarbeitung teilweise andere Hirnregionen als Normalhörende. Andererseits verarbeiten sie – zuvor während der Gehörlosigkeit – etwa Seheindrücke in dem Hirnbereich, der eigentlich für akustische Signale zuständig ist. „Crossmodale Plastizität“ nennt die Wissenschaft die Fähigkeit unseres Gehirns, bei zeitweiligem Verlust eines Sinnessystems Hirnregionen zu verwenden, die normalerweise zu einem anderen System gehören. Beim elektrischen Hören mit dem CI kann sich diese Flexibilität sowohl gut als auch schlecht auf die Hörfunktion auswirken. „Das Gehirn hat also einen entscheidenden Anteil daran, wie gut ein CI funktioniert“, stellt der Projektleiter fest.
Bislang ist es nur möglich durch genaue Hörtests festzustellen, wie gut oder schlecht eine CI-tragende Person Sprache verstehen kann. Mit den kombinierten PET/EEG-Aufzeichnungen lassen sich dagegen die Ursachen untersuchen, welche verschiedenen Hörverarbeitungsstrategien die Betroffenen einsetzen und wieso dabei ein unterschiedliches Sprachverständnis entsteht. „So können wir in Zukunft die Entwicklung therapeutischer Strategien unterstützen, welche die Anpassung an das elektrische Hören gezielt verbessern“, hofft Professor Berding. Und das hat weitreichende Folgen für CI-Nutzer. „Schwerhörigkeit beeinträchtigt nicht nur in erheblichem Maße die Teilhabe an der Gesellschaft, sondern sie hat auch erhebliche Auswirkungen auf die Lebensqualität“, betont der Hörforscher. „Sie ist ein Risikofaktor für andere altersassoziierte Störungen wie die Entwicklung von Depressionen und Demenz.“
Quelle: Medizinische Hochschule Hannover; Text: Kirsten Pötzke
15.02.2024





