Schutzmechanismus
Neue Einblicke in die Blut-Hirn-Schranke
Die Blut-Hirn-Schranke ist eine einzigartige Barriere. Wissenschaftler der Universität Würzburg haben jetzt Details ihrer Entwicklung entschlüsselt. Dies bietet neue Chancen zur Modifikation und Regulation.
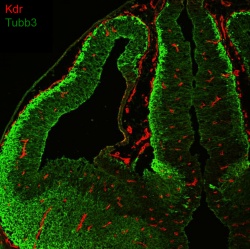
Die Blut-Hirn-Schranke ist ein wichtiger Schutzmechanismus: Als hochselektive physikalische Barriere verhindert sie, dass Krankheitserreger und Giftstoffe aus dem Blutkreislauf in das zentrale Nervensystem eindringen und dort verheerende Schäden verursachen können. Gleichzeitig bremst sie aber auch viele Medikamente aus – was die Behandlung von Krankheiten wie einem Schlaganfall, Hirntumoren oder Ödemen deutlich erschwert.
Zentrale Bausteine der Blut-Hirn-Schranke sind sogenannte Endothelzellen. Diese kleiden die Innenseite der Blutgefäße aus und blockieren mehr oder weniger den Austausch von Stoffen durch die Gefäßwand hindurch. Dabei ist Endothel nicht gleich Endothel. Denn obwohl sich alle Blutgefäße bestimmte Merkmale teilen, passt sich das Endothel spezifisch an die Bedürfnisse des zu versorgenden Organes an. Ziemlich einzigartig in dieser Hinsicht ist das Blutgefäßsystem des zentralen Nervensystems. Die Blut-Hirn-Schranke unterscheidet sich deutlich von den durchlässigeren Gefäßsystemen in anderen Organen.
Blick auf die Genaktivität
Wie die Entwicklung der Blut-Hirn-Schranke abläuft und wie sich dieser Prozess möglicherweise steuern und beeinflussen lässt: Das haben Wissenschaftler des Biozentrums der Universität Würzburg in einer neuen Studie untersucht. Sie haben dafür einen Blick auf die Genaktivität embryonaler Endothelzellen des zentralen Nervensystems der Maus geworfen und mit den Aktivitätsmustern der Endothelien anderer Organe verglichen. „Wir haben mit Hilfe der Hochdurchsatz-Sequenzierung und mit Vergleichen mit Endothelien aus anderen Geweben Faktoren identifiziert, die an der zeitlichen und räumlichen Entwicklung der Blut-Hirn-Schranke beteilig sind“, schildert Professor Manfred Gessler, Inhaber des Lehrstuhls für Entwicklungsbiochemie und Hauptautor der Studie, die Vorgehensweise der Wissenschaftler.
Dabei zeigten sich zwischen den verschiedenen Endothelien deutliche Unterschiede bei denjenigen Genen, die für Transportprozesse, Zelladhäsion und die extrazelluläre Matrix verantwortlich sind. Gleichzeitig konnten die Forscher eine Reihe von Transkriptionsfaktoren identifizieren, die mit der Entwicklung und Reifung der Blut-Hirn-Schranke assoziiert sind. „Diese Transkriptionsfaktoren agieren dabei in Abhängigkeit von dem sogenannten Wnt-Signalweg, einem Signalweg, der für die Ausbildung eines funktionellen Gefäßsystems im zentralen Nervensystem unerlässlich ist“, erklärt Gessler. Gleichzeitig ließen die Ergebnisse jedoch den Schluss zu, dass der Wnt-Signalweg zwar die Reifung und Aufrechterhaltung der Blut-Hirn-Schranke vorantreibt, nicht aber die für das Gehirn spezifische Entwicklung der Blutgefäße in Gang setzt.
Überraschende Unterschiede zwischen einzelnen Zellen
Weil die Analyse der Endothelzellen eines gesamten Organs immer nur einen Mittelwert für die Expression einzelner Gene liefert und somit keine Rückschlüsse auf den Funktionszustand einzelner Zellen erlaubt, haben die Würzburger Biochemiker weitere Experimente durchgeführt. Bei der Untersuchung von sortierten Einzelzellen aus dem Gehirn stießen sie auf unerwartete hohe Unterschiede bei der Genexpression zwischen einzelnen Endothelzellen.
„Diese erhöhte Komplexität macht es natürlich umso schwieriger, die Prozesse zur Entwicklung der Blut-Hirn-Schranke im Detail zu verstehen“, sagt Gessler. Dennoch gelang es den Wissenschaftlern eine Korrelation in der Expression bestimmter Transkriptionsfaktoren mit der Reifung der Blut-Hirn-Schranke aufzuzeigen. Die Bedeutung dieser Gene konnte mit Hilfe von Zellkultur-Experimenten untermauert werden: Zwei der untersuchten Transkriptionsfaktoren induzierten in Endothelzellen aus menschlichen Nabelvenen die Produktion verschiedener Marker der Blut-Hirn-Schranke.
Grundlage für weitere Forschung
„Die nun in der Fachzeitschrift Science Signaling veröffentlichten Ergebnisse ermöglichen neue Einblicke in die zeitliche und zellulare Komplexität der Entwicklung der Blut-Hirn-Schranke, werfen aber auch eine Vielzahl von neuen Fragen auf“, schreiben die Wissenschaftler. Gleichzeitig bilde die Studie die Grundlage für weitere Forschungen zu zellulären und molekularen Mechanismen der Blutgefäßentwicklung im zentralen Nervensystem. Darüber hinaus stellen die neu identifizierten Transkriptionsfaktoren ihrer Aussage nach potentielle Ziele zur Regulation und Manipulation der Blut-Hirn-Schranke dar und werden die Entwicklung von verbesserten Zellkulturmodellen der Blut-Hirn-Schranke ermöglichen.
Quelle: Julius-Maximilians-Universität Würzburg
17.07.2017