News • Forschung
Künstliche Intelligenz ermöglicht neue Bildgebungsmethoden
Mit seinen „ERC-Consolidator Grants“ unterstützt der Europäische Forschungsrat (ERC) exzellente junge Wissenschaftler beim Ausbau ihrer unabhängigen Karriere. Lena Maier Hein vom Deutschen Krebsforschungszentrum erhält die renommierte Förderung nun für ihr Vorhaben, molekulare Gewebeeigenschaften einfach mit Licht zu analysieren. Das besonderes an ihrem Ansatz: Sie nutzt Methoden der künstlichen Intelligenz (KI) zum einen, um realistische „digitale Zwillinge“ medizinischer Geräte und menschlicher Gewebe zu entwickeln. Darüber hinaus hilft die KI dabei, klinische Daten mit den in der virtuellen Umgebung trainierten Algorithmen zu entschlüsseln.

Gäbe es die Möglichkeit, bei Patienten nichtinvasiv und ohne schädliche Strahlung die molekulare Zusammensetzung eines Gewebes zu analysieren, so käme dies einer Revolution der Medizin gleich. Verschiedene Gewebe im Körper unterscheiden sich hinsichtlich ihres Sauerstoffgehalts, der Temperatur oder der Konzentration von Wasser oder anderen biologischen Molekülen. Gesunde Gewebe unterscheiden sich in manchen dieser Eigenschaften wiederum von kranken.
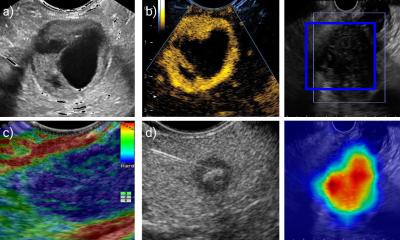
Wissenschaftler suchen daher bereits seit Jahrzehnten nach einer Methode, um diese Gewebeeigenschaften „auf einen Blick“ zu entschlüsseln. Die Techniken der spektralen Bildgebung machen sich die Tatsache zunutze, dass die verschiedenen Gewebekomponenten einzigartige optische Eigenschaften haben. Wenn Licht in biologisches Gewebe eindringt, durchläuft es komplexe Wechselwirkungen, etwa Reflexion, Absorption und Streuung. Spektrale Bildgebungstechniken, wie die multispektrale Bildgebung mit diffuser Reflexion und die Photoakustik, haben dadurch das Potenzial, wichtige Gewebeeigenschaften wie Sauerstoffgehalt, Temperatur oder die Konzentration von Wasser oder verschiedener biologischer Moleküle in hoher räumlicher Auflösung darzustellen.
Die jahrzehntelange Forschung auf diesem Gebiet hat jedoch bislang keine Methoden hervorgebracht, mit denen sich diese Gewebeparameter im klinischen Routineeinsatz akkurat quantifizieren lassen. Die Versuche, dieses Problem mit maschinellem Lernen und künstlicher Intelligenz anzugehen, scheitern häufig am Fehlen annotierter Referenzdaten, die für ein Training der Algorithmen benötigt werden. Das liegt insbesondere daran, dass es bisher keine Referenzmethode gibt, um zu den aufgenommenen Bildern die klinisch relevante Information -wie z.B. die Sauerstoffsättigung - räumlich aufgelöst zu generieren.
Maier-Hein umgeht diesen gefürchteten „Flaschenhals“, indem sie Algorithmen auf Basis von simulierten Daten trainiert. Dazu nutzt sie sämtliches Vorwissen, um simulierte Bilder mit perfekten Referenzannotationen zu erzeugen. Dadurch ist sie nicht abhängig davon, dass ihr Daten zur Verfügung gestellt werden und kann gleichzeitig regulatorische Hürden umgehen.
Doch das Lernen aus Simulationen scheitert häufig am fehlenden Realismus der Simulation – das heißt, das vorhandene Wissen reicht nicht aus, um vollkommen realistische Bilder zu simulieren. KI-Forscher bezeichnen dieses Problem als „domain gap“. Maier-Hein geht noch einen Schritt weiter und nutzt KI-Methoden, um diese „Lücke“ zu überwinden. Sie setzt die KI also gleich doppelt ein: Zum einen für die Entschlüsselung der Bilder und zusätzlich, um die Simulation zu verbessern. Das Konzept soll es den bildgebenden Systemen also ermöglichen, aus ihren Erfahrungen zu lernen.
Quellle: Deutsches Krebsforschungszentrum
10.12.2020