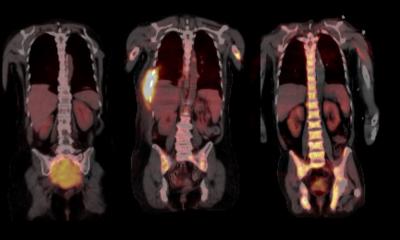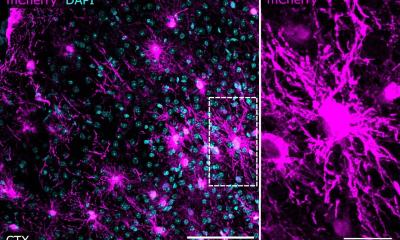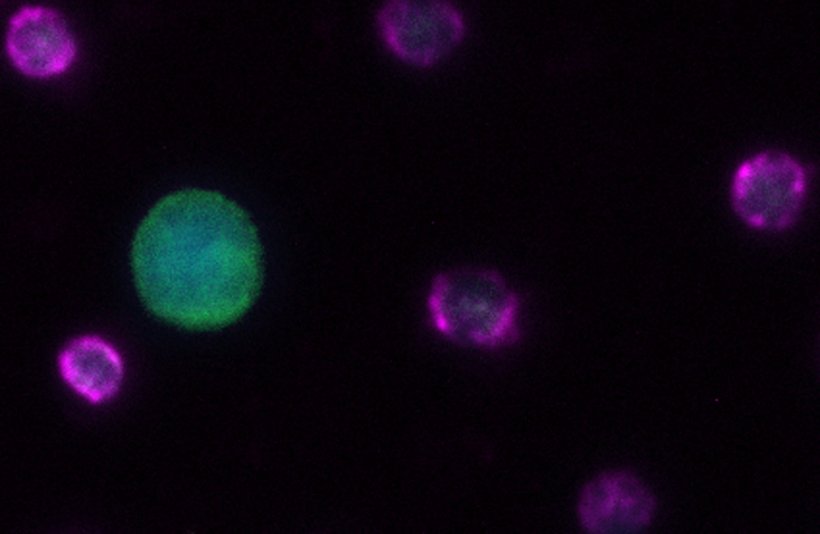
© Lisa-Marie Rieckmann, DKFZ-Hector Krebsinstitut an der UMM
News • Krebsforschung
Zirkulierende Tumorzellen öffnen neue Wege für personalisierte Onkologie
Ein verbessertes Verfahren zur Isolierung zirkulierender Tumorzellen ebnet den Weg für maßgeschneiderte Therapien in der personalisierten Onkologie:
Wissenschaftler vom DKFZ-Hector Krebsinstitut an der Universitätsmedizin Mannheim zeigen in einer aktuellen Studie, dass es möglich ist, über eine Anreicherungstechnik von Blutzellen (Diagnostische Leukapherese) ausreichend zirkulierende Tumorzellen zu gewinnen, um den Tumor und dessen Heterogenität umfassend analysieren zu können. Dies ist ein wichtiger Schritt hin zur personalisierten Onkologie: „Damit können wir zukünftig minimal invasiv – mittels Blutprobe – tiefe Einblicke in das Ansprechen eines jeden Patienten auf seine Therapie bekommen“, so Professor Dr. Dr. Sonja Loges, die die Studie gemeinsam mit Dr. Melanie Janning geleitet hat.
Die Wissenschaftler stellen ihre Erkenntnisse im Fachjournal Molecular Cancer vor.
Wir sind davon überzeugt, dass CTCs ein Schlüsselelement sind, um Krebsdynamik besser zu verstehen. Die Methodik ebnet damit den Weg für maßgeschneiderte therapeutische Interventionen in der personalisierten Onkologie
Melanie Janning
Leukapheresen werden in der Hämatologie normalerweise angewandt, um gezielt Leukozyten aus dem Blut zu filtern, beispielsweise um Blutstammzellen für eine Transplantation zu gewinnen. Das Blut wird hierzu in einem Zellseparator durch Zentrifugation in seine Bestandteile aufgetrennt, weiße Blutzellen selektiv entfernt und die restlichen Blutbestandteile dem Patienten wieder zugeführt.
Tumore sind heterogen: Sie können sich in verschiedenen Teilen des Tumors voneinander unterscheiden. In der Krebsforschung kommt diesem Phänomen eine wichtige Bedeutung zu, da sich zelluläre und molekulare Unterschiede innerhalb eines Tumors sowohl auf die Diagnostik als auch auf den Einsatz von zielgerichteten Therapien auswirken können. So ist die Heterogenität ein wesentlicher Grund für die Entwicklung von Resistenzen gegenüber Therapien.
Im Blut zirkulierende Tumorzellen (CTCs), potenzielle Vorläufer von Metastasen, stellen eine vielversprechende Möglichkeit dar, die Heterogenität von Tumoren zu entschlüsseln. Ebenso wie die Analyse von im Blut zirkulierender Tumor-DNA (ctDNA), ist die Analyse von CTCs eine Form der Liquid Biopsy (Flüssigbiopsie), bei der das Blut auf Biomarker hin untersucht wird. Das Verfahren wird in der Krebsforschung und Krebsdiagnostik zu unterschiedlichen Zwecken eingesetzt: zum Screening und zur Krebsfrüherkennung, zum Abschätzen des Metastasierungsrisikos, um Zielstrukturen für die Therapie und Resistenzmechanismen zu identifizieren, und für das Tumor-Monitoring.
Dieser Artikel könnte Sie auch interessieren

News • Blutprobe statt Biopsie
Liquid Biopsy für bessere Krebsdiagnostik bei Hirntumoren
Anstelle der bislang üblichen Gewebeprobe könnte die Liquid Biopsy Bruchstücke von Tumorzellen aufspüren – insbesondere bei Hirntumoren wäre dies ein großer Vorteil.
Die Analyse von CTCs stößt jedoch oft an ihre Grenzen, weil konventionelle Methoden zur Identifizierung von CTCs häufig nur sehr geringe Zellzahlen liefern, zu gering für eine valide Analyse des Tumors. So ist es auch beim nicht-kleinzelligen Lungenkarzinom (NSCLC). Diese Grenze konnten die Wissenschaftler vom DKFZ-Hector Krebsinstitut überwinden, indem sie eine innovative zweistufige Vorgehensweise zur Anreicherung und Isolierung von CTCs entwickelten. Sie basiert darauf, Blutzellen aus dem bei der Leukapherese gewonnenen Zellkonzentrat zu entfernen und so größere Volumina von Patientenblut der Zellseparation zu unterziehen.
In der vorliegenden Studie wurde diese Form der DLA an sechs Patienten mit fortgeschrittenem nicht-kleinzelligem Lungenkarzinom angewendet. Dabei gelang es den Forschern, eine bisher unerreichte Anzahl von insgesamt mehr als 3.360 CTCs zu identifizieren, die sie anschließend umfassend analysieren konnten. Die Ergebnisse lieferten ungeahnte Einblicke in die Krebsheterogenität. Der Vergleich der aktiven Gene (auf Basis der Transkriptome) von CTCs mit denen von primären NSCLC-Zellen zeigte, dass die zirkulierenden Tumorzellen einerseits die Heterogenität ihrer primären Pendants widerspiegeln und gleichzeitig einzigartige CTC-spezifische Merkmale aufweisen.
"Aufgrund der großen Zahl von CTCs, die uns zur Analyse zur Verfügung standen, konnten wir nicht nur die diagnostische Bedeutung von zirkulierenden Tumorzellen bei der Darstellung von Tumorheterogenität bestätigen. Es ist uns außerdem gelungen, potenzielle CTC-spezifische Signaturen zu identifizieren, die für zielgerichtete Therapien in der Zukunft genutzt werden können", sagt Dr. Lisa-Marie Rieckmann, eine der Erstautorinnen der Studie.
Dr. Melanie Janning, Letztautorin der Arbeit, fügt hinzu: "Diese umfassende Methode zur Charakterisierung von zirkulierenden Tumorzellen stellt eine wesentliche Weiterentwicklung für die Krebsforschung dar. Wir sind davon überzeugt, dass CTCs ein Schlüsselelement sind, um Krebsdynamik besser zu verstehen. Die Methodik ebnet damit den Weg für maßgeschneiderte therapeutische Interventionen in der personalisierten Onkologie."
Die Studie wurde in enger Zusammenarbeit zwischen dem DKFZ in Heidelberg und der Universitätsmedizin Mannheim (UMM) sowie dem Universitätsklinikum Hamburg-Eppendorf durchgeführt und unterstreicht die Bedeutung interdisziplinärer Kooperationen bei der Erforschung neuer Krebstherapien.
Quelle: Universitätsmedizin Mannheim
12.05.2024