Artikel • Checkpoint-Inhibitoren
Immuntherapie bei Lungenkrebs – viele Bälle in der Luft
Bessere Therapieergebnisse und günstigere Prognosen – für Onkologen, die Patienten mit Lungenkrebs behandeln, war dies über lange Zeit Zukunftsmusik. Die Checkpoint-Inhibitoren scheinen nun vieles möglich zu machen. Aber nicht immer und nicht bei jedem Patienten. Und auch sonst sind diese Medikamente ein zweischneidiges Schwert.
Professor Cornelia Schäfer-Prokop, seit 2009 Radiologin am Meander Medical Centre Armersfort in den Niederlanden, erläutert die Chancen und Risiken.
Enttarnung als Wirkprinzip

Auf der Oberfläche von T-Zellen sind bestimmte Proteine (Checkpoints) angesiedelt, die zwischen fremdem Tumorgewebe und körpereigenem Gewebe unterscheiden können. Tumorzellen blockieren diese Checkpoints. In der Folge erkennt das Immunsystem die Tumorzellen nicht mehr als Fremdgewebe, eine Abwehrreaktion des Immunsystems bleibt aus.
Checkpoint-Inhibitoren sind Medikamente, die diese Blockade wieder auflösen, und den Prozess der Abwehr wieder in Gang setzen. Zur Therapie von Lungenkrebs sind bislang verschiedene PD1- und PD-L1-Hemmer zugelassen. Schäfer-Prokop: „Ein sehr wirksamer Mechanismus, der laut Literatur aber leider nur bei 20-40% Prozent der Fälle erfolgreich ist“.
Genexpression als Indikator für die Response
Vor einer Indikation für einen Checkpoint-Inhibitor wird der Tumor charakterisiert: Mit der Biopsie lässt sich der histologische Subtyp analysieren. Die genetische Charakterisierung identifiziert zum Beispiel Mutationen wie EGFR- oder ALK, die das Tumorwachstum begünstigen. Mit der Bestimmung der Genexpression lässt sich ermitteln, wie viele Proteinliganden beim Tumorgewebe tatsächlich vorhanden sind. Je mehr Liganden da sind, desto größer ist die Wahrscheinlichkeit, dass die Therapie mit Checkpoint-Inhibitoren funktioniert. Bei Expressionsraten von über 50 Prozent ist eine gute Response zu erwarten. „Allerdings, und das macht es kompliziert, gibt es auch Patienten, die trotz niedrigerer PDL-Expression auf die Immuntherapie ansprechen“, so Schäfer-Prokop. Onkologen sehen sich daher oft in der Pflicht, auch bei niedrigen Genexpressionen zumindest einen Therapieversuch zu machen.
Hohe Erwartungen
Nach Dekaden schlechter Therapierbarkeit und sehr ungünstiger Prognosen sehen viele Kliniker in den Checkpoint-Inhibitoren ein potentes Mittel, um Lungenkarzinome mit deutlich größerem Erfolg zu therapieren. Aus bisher wenigen Monaten können in erfolgreichen Fällen 12, 15 oder gar 18 Monate mehr Überlebenszeit werden. „Das erklärt den großen Enthusiasmus der Onkologen“, meint Schäfer-Prokop. Die Kehrseite der Medaille: Die Medikamente sind sehr teuer und haben erhebliche Nebenwirkungen. Weil sie relativ unspezifisch in das Immunsystem des ganzen Körpers eingreifen, kann es zu starken Entzündungsreaktionen in den Organen kommen wie beispielsweise Pankreatitis, Hepatitis, Pneumonitis, Colitis etc., die den Patienten stark beeinträchtigen. Und last but not least: Längst nicht alle Patienten profitieren von dieser Therapie.
Prospektive Einschätzung schwierig
Die molekulare Bildgebung, aber auch die Analyse von Stoffen, die aus dem Blut gewonnen werden, aus den Immunzellen oder aus immunohistochemischen Details vom Tumor selbst – all das ist denkbar
Cornelia Schäfer-Prokop
Sinnvoll wäre es daher, im Vorfeld zu wissen, ob ein Lungenkrebspatient einen Vorteil von der Behandlung haben wird oder nicht. Zurzeit wird daher intensiv nach Biomarkern geforscht, etwa nach immunohistochemischen Faktoren in der Mikroumgebung des Tumors oder der ‚mutational load‘, also der Anzahl der Genmutationen, die ein Tumor aufweist. Schäfer-Prokop: „Hier befinden wir uns aber noch im Bereich der Forschung.“ Fest steht, dass die Bildgebung bei der Responsebeurteilung über die reine Morphologie hinausgehen muss. Denn allein den Durchmesser des Tumors oder die Lymphknoten als Maßstab für ein Therapieansprechen heranzuziehen, reicht wegen seines gelegentlich pseudo- bzw. hyperprogressiven Verhaltens nicht aus. Denkbar ist die Zuhilfenahme der molekularen Bildgebung mit bestimmten PET-Tracern oder aber biomedizinische Mikrosysteme (BIOMICS), mit denen die Bilddaten ausgelesen werden. Schäfer-Prokop selbst geht davon aus, dass eine Kombination verschiedener Informationsquellen Abhilfe schaffen wird: „Die molekulare Bildgebung, aber auch die Analyse von Stoffen, die aus dem Blut gewonnen werden, aus den Immunzellen oder aus immunohistochemischen Details vom Tumor selbst – all das ist denkbar.“
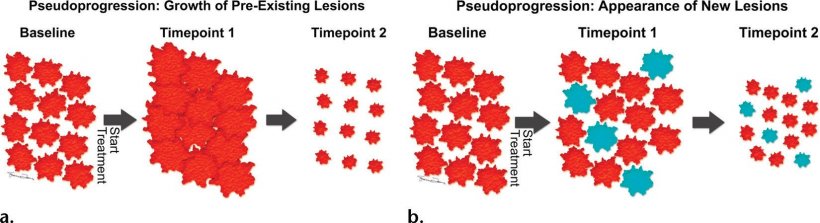
Bildquelle: Wang et al. 2017; RadioGraphics
Unter Immuntherapie manchmal zunächst Progression
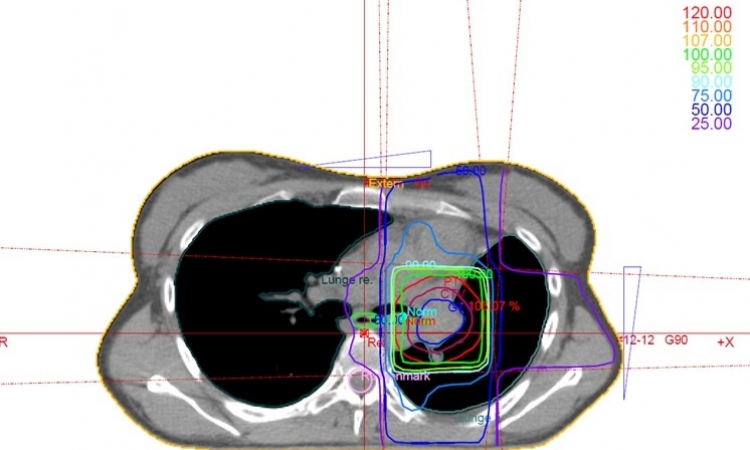
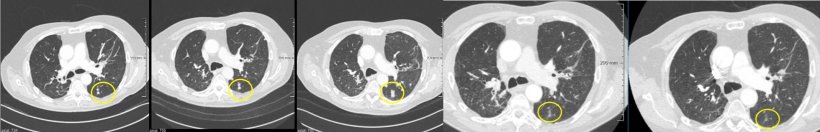
Um das Ansprechen auf eine Lungenkrebstherapie zu evaluieren steht seit 2009 die Leitlinie RECIST zur Verfügung. RECIST 1.1 wird üblicherweise verwendet, um bei traditioneller Chemotherapie zu bestimmen, inwiefern der Tumor respondiert oder nicht. Die Einschätzung beruht auf rein morphologischen Merkmalen, also dem Durchmesser bestimmter Target-Läsionen oder Lymphknoten und dem Auftreten neuer Läsionen. „Wenn das Tumorvolumen über einen bestimmten Prozentsatz hinaus zugenommen hat oder aber eine neue Läsion detektiert wird, ist die Schlussfolgerung Progression“, so die Expertin. Inzwischen hat sich herausgestellt, dass diese Kriterien für die Immuntherapie nicht funktionieren. Denn es ist zu beobachten, dass unter Therapie der Tumor in einigen Fällen zunächst größer wird, bevor er dann, Wochen später, deutlich schrumpft. Dafür gibt es zwei Erklärungsansätze: Bei der ersten Kontrolle hat das Immunsystem zwar begonnen, zu reagieren, der Tumor aber noch nicht, so dass er weiterwächst. Oder die aktivierten T-Zellen infiltrieren den Tumor und die Mischung aus Tumor und Immunreaktion führt wiederum erst zu einer Vergrößerung des Tumorvolumens. Und erst bei einer zweiten Kontrolle stellt sich heraus, dass der Tumor geschrumpft oder die neue Läsion stabil geblieben oder sogar kleiner geworden ist.
Leitlinie RECIST zweimal angepasst
Wichtigstes Kriterium ist, dass sich die Zunahme des Tumors in einer zweiten Kontrolle durchgesetzt hat
Cornelia Schäfer-Prokop
Diese Beobachtungen haben dazu geführt, dass 2009 sogenannte irRC-Kriterien aufgestellt wurden. Danach kann erst dann von einer ‚confirmed‘ Progression gesprochen werden, wenn der Tumor nach mindestens zwei konsekutiven Untersuchungen um mindestens 20% Prozent größer geworden ist. 2017 wurden diese Kriterien nochmals angepasst (iRECIST).
Aktuell wird auch dann noch von einer ‚unconfirmed‘, also nicht bestätigten Progression ausgegangen, wenn der Tumor bei der ersten Kontrolle größer geworden ist und eine neue Läsion aufgetreten ist. Eine ‚confirmed progression‘ liegt nur dann vor, wenn der Tumor bei einer nächsten Kontrolle weitergewachsen oder die Läsion gewachsen ist oder aber eine zweite Läsion identifiziert wird. Schäfer-Prokop: „Wichtigstes Kriterium ist, dass sich die Zunahme des Tumors in einer zweiten Kontrolle durchgesetzt hat.“ Die Unvorhersehbarkeit – wächst der Tumor immer weiter oder wird er doch kleiner – macht es schwierig, zu entscheiden, ob weiter behandelt werden soll oder nicht. Letztendlich beruht die Therapieentscheidung auf einem Zusammenspiel von klinischem Status, der Chancen-Abschätzung des Onkologen, dem PD-L1-Status, der histologischen Untergruppe und der Beurteilung des Radiologen.
Profil:
Prof. Dr. Cornelia Schäfer-Prokop arbeitet seit 2009 als Radiologin am Meander Medical Centre, Amersfoort (Niederlande) und darüber hinaus als Wissenschaftlerin am Department of Radiology and Nuclear Medicine am Radboud University Medical Center in Njimegen. Zuvor war sie in Hannover (1993-1998), am AKH Wien (1998-2004) und AMC Amsterdam (2005-2009) tätig. Ihre Forschungsschwerpunkte liegen in der digitalen Radiographie, Computer-Aided Detection und Klassifikation und der Diagnostik interstitieller Lungenerkrankungen. Sie ist bzw. war Mitglied des Editorial Boards von „European Radiology“, „Journal of Thoracic Imgaing“, „Radiology“ sowie „Insights into Imaging“ und Mitglied der Fleischner Gesellschaft.
23.01.2020