News • Wachstumsstrategien von Tumorzellen
Warum Lymphdrüsenkrebs das Gehirn befällt
Das primäre Lymphom des Zentralnervensystems ist ein spezieller Lymphdrüsenkrebs, der ausschließlich im Gehirn auftritt. Die Häufigkeit dieses bösartigen Tumors hat weltweit zugenommen und zumeist eine schlechte Prognose.
Im Rahmen eines von der Wilhelm Sander-Stiftung geförderten Forschungsprojektes an der Uniklinik Köln haben Forscher um Martina Deckert und Manuel Montesinos-Rongen nun besondere Wechselwirkungen zwischen den Krebszellen und dem Gehirn entdeckt. Ihre Untersuchungen liefern nicht nur eine Erklärung, warum diese Tumorart gerade im Gehirn auftritt und weshalb die Heilungschancen so schlecht sind, sondern bieten auch neue Ansätze für die Entwicklung gezielterer Therapieformen.
Die Forscher haben ihre neuen Erkenntnisse kürzlich in der Fachzeitschrift Haematologica publiziert.
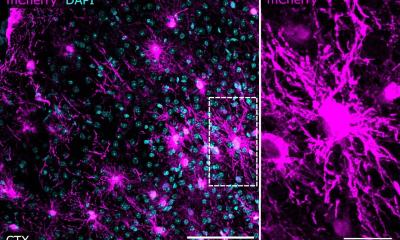
© Martina Deckert, Köln
Es ist ein erstaunliches Phänomen, dass es spezielle Arten von Lymphdrüsenkrebs gibt, die im Gehirn auftreten. Diese können sich sogar ausschließlich als sogenannte „primäre ZNS-Lymphome“ im Gehirn manifestieren. Offenbar entwickeln diese bösartigen Krebszellen besondere Strategien, die es ihnen ermöglichen, sich besonders leicht im Gehirn zu vermehren. Dies ist für erkrankte Patienten lebensbedrohlich, weil derzeitig verfügbare Therapien keine Heilung bewirken können.
Um zu verstehen, welche Strategien die bösartigen Zellen nutzen, um im Gehirn besonders schnell wachsen zu können, hat die Arbeitsgruppe von Prof. Dr. Martina Deckert und Prof. Dr. Manuel Montesinos-Rongen am Institut für Neuropathologie der Uniklinik Köln jetzt im Rahmen eines von der Wilhelm Sander-Stiftung geförderten Forschungsprojektes die Entwicklung des für diese Zellen einzigartigen sogenannten B-Zell-Rezeptors detailliert charakterisiert. Der B-Zell-Rezeptor vermittelt wesentliche Signale zwischen der Umgebung der Zelle und dem Zellinneren, wobei seine spezifische Bindung an Proteine der Umgebung von zentraler Bedeutung ist.
Den Forschern ist es nun durch molekulare Untersuchungen gelungen, Veränderungen des B-Zell-Rezeptors im Laufe der Entwicklung zur Tumorzelle zu verfolgen. Sie konnten zeigen, dass die bösartigen Krebszellen sich aus Vorläuferstadien entwickeln, welche körpereigene Bestandteile erkennen. Aufgrund dieser Merkmale hätten sie eigentlich im gesunden Organismus eliminiert werden müssen. Sie konnten ihrem Todessignal, dem sogenannten programmierten Zelltod, jedoch entgehen, weil sie bereits spezifische genetische Eigenschaften durch Mutationen erworben hatten, die ihnen einen Überlebensvorteil bieten. So können sie unentdeckt an der im Körper ständig stattfindenden Reifung von B-Lymphozyten teilnehmen.

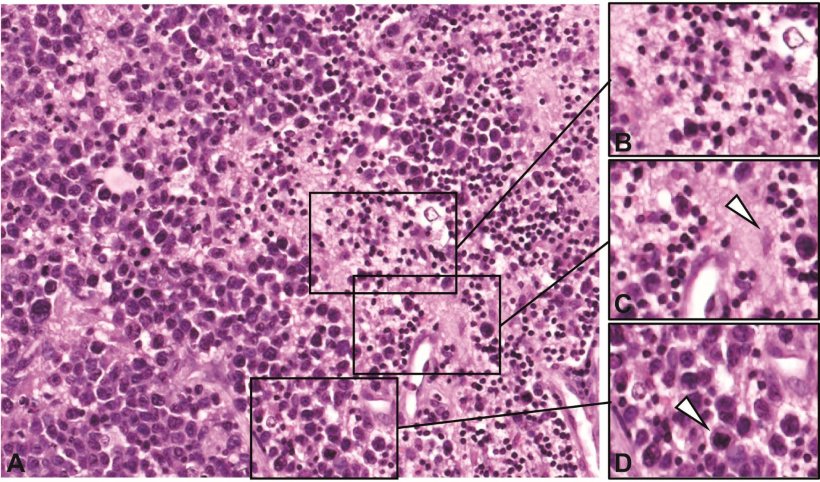
© Martina Deckert, Köln
Ein besonders wichtiger Teilprozess der physiologischen Reifung von B-Lymphozyten ist die Veränderung (Modulation) ihres B-Zell-Rezeptors, wodurch er mit Strukturen der Umgebung der Zelle besonders gut interagieren kann. In diesem Prozess kann es im Organismus zu einer weiteren, folgenschweren Fehlentscheidung kommen, welche für die Krebsentstehung mitverantwortlich ist: Die Krebsvorläuferzelle nimmt zwar an einem Teilprozess der Reifung teil, erreicht aber nicht ihr Ziel. Stattdessen verändert sie ihren B-Zell-Rezeptor so, dass er viele Strukturen anstelle einer einzigen erkennt. Eine solche Veränderung ist für den gesunden Organismus ein Signal, das normalerweise den programmierten Zelltod in Gang setzt. Doch auch an dieser Stelle greifen die üblichen Kontrollmechanismen nicht mehr. Das Versäumnis einer Eliminierung der Krebsvorläuferzelle ist besonders fatal, weil diese im Laufe ihrer Entwicklung weitere genetische Eigenschaften erworben hat, die sie befähigen, sich ungehemmt zu vermehren.
Für den Befall des Gehirns ist also entscheidend, dass die Zelle – neben ihrer Entwicklung hin zur bösartigen Krebszelle – ihren B-Zell-Rezeptor so verändert hat, dass er viele Strukturen im Gehirn erkennen kann. Dadurch ist die Zelle nun in der Lage, die Interaktion mit diesen hirneigenen Strukturen geschickt zu nutzen, um darüber Signalwege für ihr Wachstum und ihre Vermehrung zu aktivieren.
Diese neuen Erkenntnisse der Kölner Forscher sind für das Verständnis der bislang unklaren Organaffinität (Tropismus) dieser Form von Lymphdrüsenkrebs zum Gehirn und dessen Aggressivität von grundlegender Bedeutung. Daraus ergibt sich nun die Herausforderung, passgenaue therapeutische Konzepte zu entwickeln, deren Ziel es ist, die Krebsvorläuferzellen in einem frühen Stadium ihrer Entwicklung zu entfernen bzw. die Interaktion des B-Zell-Rezeptors mit Strukturen im Gehirn zu unterbinden.
Quelle: Wilhelm-Sander-Stiftung
23.05.2020