Bildquelle: Leibniz-HKI
News • Koinfektions-Strategien
Pilze und Bakterien können gefährliche Allianz bilden
Forschende entdecken neue Koinfektions-Strategien von Candida albicans und Enterococcus faecalis
Rivalen oder Verbündete – wie interagieren Bakterien und Pilze in unserem Körper? Bisher galten Bakterien auf unseren Schleimhäuten vor allem als Gegenspieler von Pilzen, da sie deren Wachstum hemmen können. Ein internationales Forschungsteam unter Leitung des Leibniz-Instituts für Naturstoff-Forschung und Infektionsbiologie (Leibniz-HKI) in Jena konnte nun jedoch zeigen, dass der Hefepilz Candida albicans und das Bakterium Enterococcus faecalis unter bestimmten Bedingungen eine gefährliche Allianz bilden: Statt sich zu bekämpfen, können sie ihre Wirkung dann verstärken und gemeinsam deutlich schwerere Zellschäden verursachen als allein. In der jetzt im Fachjournal PNAS veröffentlichten Studie enthüllen die Forschenden die dahinterstehenden Mechanismen – und die entscheidende Rolle des bakteriellen Giftstoffs Cytolysin.
Das erklärt, warum es mitunter zu schwereren klinischen Verläufen kommt, obwohl scheinbar die gleichen Mikroorganismen beteiligt sind
Ilse Jacobsen
Der Hefepilz Candida albicans und das Bakterium Enterococcus faecalis sind meist harmlose Bewohner unserer Schleimhäute. Wenn das Immunsystem geschwächt ist oder das Gleichgewicht der Mikroben gestört wird – etwa nach einer Antibiotikatherapie – können sie jedoch Infektionen auslösen. Wie schwer eine Infektion verläuft, hängt dabei auch davon ab, wie die beiden Mikroben miteinander interagieren. „Meist wird untersucht, wie Bakterien und Pilze sich gegenseitig hemmen“, sagt Ilse Jacobsen, Leiterin der Abteilung Mikrobielle Immunologie am Leibniz-HKI. „Wir wollten wissen, warum sie unter bestimmten Bedingungen zusammenarbeiten und dadurch deutlich mehr Schaden anrichten können und welche Faktoren das beeinflussen.“
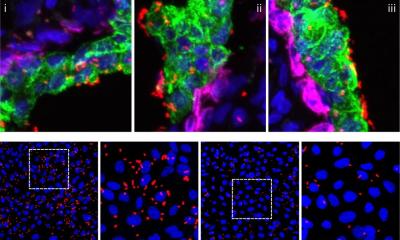
Um diese Zusammenarbeit besser zu verstehen, testete das Team zahlreiche E. faecalis-Stämme in Zellkulturmodellen. Dabei stellten sie fest, dass nur einige von ihnen die Zellschädigung bei gleichzeitiger Infektion mit Candida albicans deutlich verstärkten. Diese Stämme einte eine auffällige Eigenschaft: Sie produzierten Cytolysin, einen Giftstoff, der Zellmembranen durchlöchert und die Zellen so abtötet. Fehlte das entsprechende Gen im Bakterium, blieb der zusätzliche Schaden aus. Wurde es hinzugefügt, trat der Effekt wieder auf. Die Erkenntnisse aus den Zellkulturen bestätigten sich auch im Mausmodell. Cytolysin-bildende Bakterienstämme verstärkten die Schleimhautschädigung durch Candida albicans, während Varianten ohne das Gift sogar einen abschwächenden Effekt hatten. „Nicht alle Enterokokken sind gleich“, betont Jacobsen. „Hier haben sich die Cytolysin-bildenden Varianten als die gefährlichen herausgestellt. Das erklärt, warum es mitunter zu schwereren klinischen Verläufen kommt, obwohl scheinbar die gleichen Mikroorganismen beteiligt sind.“
Neben der zentralen Rolle des Cytolysins konnte das Forschungsteam zwei Hauptmechanismen identifizieren, die die gefährliche Allianz der beiden Mikroben erklären:
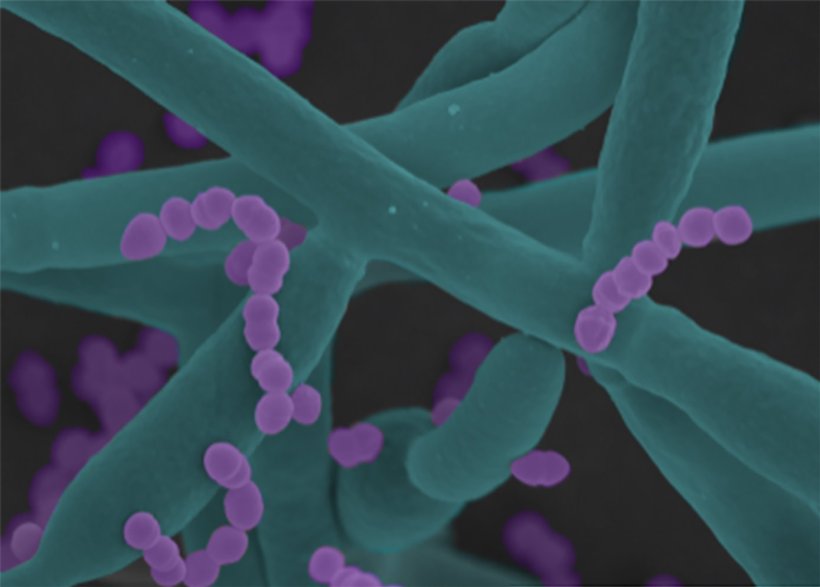
- Direkter Kontakt: Die Bakterien heften sich an die Pilzzellen an und gelangen dadurch in engen Kontakt mit den Wirtszellen. So kann das bakterielle Gift Cytolysin genau dort wirken, wo es den größten Schaden anrichtet.
- Nährstoffverarmung: Candida albicans verbraucht Zucker (Glukose) besonders schnell. Der daraus resultierende Energiemangel schwächt die Wirtszellen und macht sie anfälliger für das bakterielle Gift.
So schaffen Pilz und Bakterium gemeinsam eine Umgebung, in der sie ihre zerstörerische Wirkung voll entfalten und massive Zellschädigungen verursachen können – ein eindrucksvolles Beispiel dafür, wie komplexe mikrobiologische Wechselwirkungen den Verlauf einer Infektion prägen.
„Die Ergebnisse unserer Studie zeigen, dass die Gefährlichkeit einer Infektion nicht nur von einer einzelnen Art abhängt, sondern davon, welche Mikroben zusammentreffen, und welche Werkzeuge sie dabei einsetzen“, sagt Jacobsen. „Das hilft uns, besser zu verstehen, warum manche Infektionen so schwer verlaufen und könnte langfristig dabei helfen, gezieltere Therapien gegen kombinierte Infektionen zu entwickeln.“
Die Studie wurde von Ilse Jacobsen geleitet. Die Tierärztin leitet eine Abteilung am Leibniz-HKI und ist Professorin an der Universität Jena. Am Projekt haben weitere Forschende des Leibniz-HKI, der Universitätskliniken Jena, Tübingen und Los Angeles, sowie der Nanyang Technological University in Singapur mitgewirkt. Gefördert wurde das Projekt wurde unter anderem durch das Bundesministerium für Forschung, Technologie und Raumfahrt (BMFTR) über das Jenaer Zentrum für Sepsis und Sepsiskontrolle (CSCC) und durch die Deutsche Forschungsgemeinschaft (DFG) im Rahmen des Exzellenzclusters „Balance of the Microverse“.
Quelle: Leibniz-Institut für Naturstoff-Forschung und Infektionsbiologie
09.02.2026