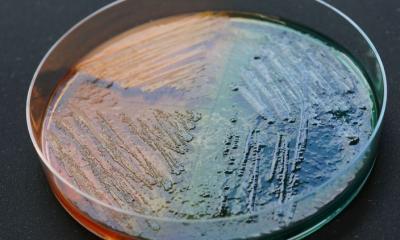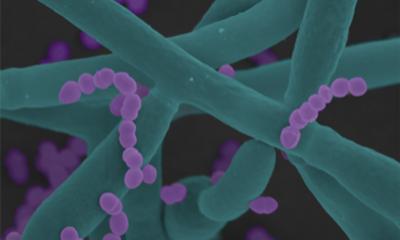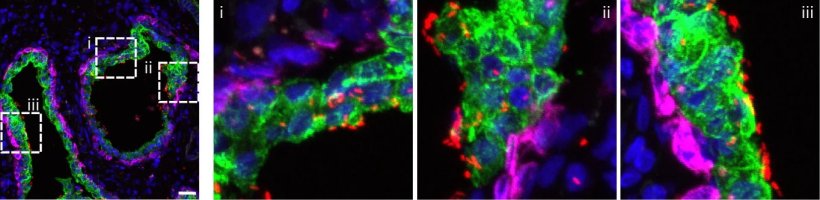
Bildquelle: Guedes M, Peters S, Joshi A et al., Nature Microbiology 2026 (CC BY 4.0)
News • Wie E. coli in die Prostata gelangt
Bakterielle Prostatitis: Labormodell enthüllt Infektionsweg
Die bakterielle Prostatitis, eine Infektion der Prostata, die in erster Linie durch Escherichia coli (E. coli) verursacht wird, ist ein häufiges Gesundheitsproblem bei Männern. Weltweit sind etwa ein Prozent aller Männer im Laufe ihres Lebens davon betroffen.
Die Infektion entsteht, wenn Bakterien aus der Harnröhre oder der Blase in die Prostata gelangen. Die Behandlung der bakteriellen Prostatitis ist nach wie vor schwierig, da die Patienten oft lange Antibiotikabehandlungen mit hohen Dosen benötigen. Trotz Behandlung erleiden mehr als die Hälfte der Patienten innerhalb eines Jahres einen Rückfall.
Seit langem vermuten Forscher, dass Bakterien in die Prostatazellen eindringen, um zu überleben und dem Immunsystem und Antibiotika zu entkommen. Bislang fehlten jedoch direkte Beweise für diese Überlebensstrategie.
Angesichts der aktuellen Antibiotikaresistenzkrise ist es unser Ziel, neue Therapien zu entwickeln, die E. coli und andere Bakterien ohne den Einsatz von Antibiotika bekämpfen können
Carmen Aguilar
Bislang war die Erforschung von Prostata-Infektionen schwierig, da es keine geeigneten Labormodelle gab, die das echte Gewebe genau nachahmen. Ohne die Möglichkeit, Infektionen in der realen Gewebeumgebung zu beobachten, war die Entwicklung alternativer Therapien, jenseits von Antibiotika, nahezu unmöglich. Das hat sich nun geändert.
Ein Forschungsteam der Julius-Maximilians-Universität Würzburg (JMU) hat ein „Mini-Prostata”-Organoidmodell aus adulten Stammzellen entwickelt. Dieses im Labor gezüchtete Modell ahmt das echte Prostataepithel in Struktur und Zellvielfalt nach. Mithilfe dieses Modells konnten die Wissenschaftler die Infektion Schritt für Schritt unter realistischen, kontrollierten Bedingungen nachvollziehen und genau identifizieren, wie die Bakterien angreifen. Dies liefert klare Hinweise für die Entwicklung gezielter Gegenmaßnahmen.
Dr. Carmen Aguilar, Nachwuchsgruppenleiterin am Institut für Molekulare Infektionsbiologie (IMIB) der Universität Würzburg, leitete die Studie gemeinsam mit Kollegen des Universitätsklinikums Würzburg (UKW), des Helmholtz-Instituts für RNA-basierte Infektionsforschung (HIRI) und der Universität Münster. Die Ergebnisse des Teams wurden in der aktuellen Ausgabe der Fachzeitschrift Nature Microbiology veröffentlicht.
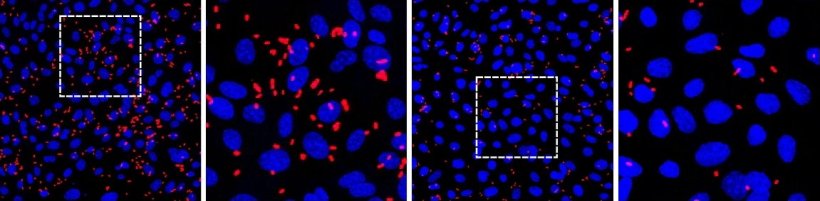
Bildquelle: Guedes M, Peters S, Joshi A et al., Nature Microbiology 2026 (CC BY 4.0)
„Wir haben gezeigt, dass die Invasion von E. coli in Prostatazellen kein zufälliger Prozess ist, sondern eine hochgradig koordinierte Operation, die eine bestimmte Schwachstelle in der Zellarchitektur des Prostataepithels ausnutzt“, erklärt Carmen Aguilar. Ihren Erkenntnissen zufolge kann E. coli nicht wahllos angreifen, sondern konzentriert sich auf einen bestimmten Zelltyp: die sogenannten Luminalzellen, welche die Drüsenkanäle der Prostata auskleiden und als erste mit den Bakterien in Kontakt kommen, wenn diese die Prostata erreichen.
Diese Invasion funktioniert nach einem „Schlüssel-Schloss-Prinzip“. Das bakterielle Protein FimH fungiert als „Schlüssel“, der genau in ein „Schloss“ auf der Oberfläche der Luminalzellen der Prostata passt. Die Forscher identifizierten dieses Schloss als den prostataspezifischen Rezeptor PPAP (prostataspezifische saure Phosphatase). „Nur wenn das bakterielle Protein an diesen Prostatarezeptor bindet, können die Bakterien in die Zellen eindringen, sich dort sicher vermehren und die Infektion auslösen“, erklärt Aguilar.
Das Team begnügte sich jedoch nicht damit, den Infektionsweg zu entdecken. Es identifizierte auch eine Möglichkeit, diese Interaktion mit einem einfachen Zuckermolekül namens D-Mannose zu blockieren. Dieser Zucker, der bereits zur Vorbeugung und Behandlung von Blasenentzündungen eingesetzt wird, fungiert als „Scheinschloss“.
Die bakteriellen „Schlüssel“ binden dieses harmlose Zuckermoleküle anstelle der echten Rezeptoren auf den Prostatazellen und blockieren so wirksam das bakterielle Eindringen in die Zellen. Im Labor hat der Einsatz von D-Mannose bereits zu einer signifikanten Verringerung der Infektionen geführt, was auf eine mögliche neue Strategie zur Vorbeugung und Behandlung von Prostata-Infektionen hindeutet.
Das bahnbrechende Organoid-Modell bietet Forschern nun ein leistungsstarkes Werkzeug, um Prostata-Infektionen in bisher unerreichter Detailgenauigkeit zu untersuchen. Mit diesem System untersucht das Team von Dr. Aguilar nun, wie E. coli nach dem Eindringen in die Prostatazellen überlebt und sich vermehrt. Das Modell ermöglicht es Wissenschaftlern darüber hinaus, auch die Infektionsstrategien anderer relevanter Prostatapathogene wie Klebsiella oder Pseudomonas zu untersuchen.
„Angesichts der aktuellen Antibiotikaresistenzkrise ist es unser Ziel, neue Therapien zu entwickeln, die E. coli und andere Bakterien ohne den Einsatz von Antibiotika bekämpfen können. Zunächst müssen wir jedoch vollständig verstehen, wie diese Infektionen funktionieren“, sagt Carmen Aguilar. Solche Ansätze könnten eine wirksame Alternative zu herkömmlichen Antibiotika darstellen und einen wichtigen Beitrag zur Bekämpfung der Antibiotikaresistenz leisten.
Diese Arbeit wurde vom Bundesministerium für Forschung, Technologie und Raumfahrt (BMFTR, FiRe-UPec-Projekt) und von der Deutschen Forschungsgemeinschaft (DFG, GRK 2157 3D Infect) gefördert.
Quelle: Universität Würzburg
13.01.2026