Bildquelle: Medizinische Universität Innsbruck
News • Präzisions-Onkologie
PBRM-1-Gallenwegstumor: neue Therapiemöglichkeiten gefunden
Forscher der Kinik für Innere Medizin V an der Medizinischen Universität Innsbruck konnten mit der „Precision Oncology Alliance“ das molekulare Profil einer Subgruppe von Gallenwegstumoren mit PBRM1 Mutationen charakterisieren.
Infolge der genetischen Analyse wurden neue Angriffspunkte für zielgerichtete Therapieoptionen identifiziert. Die Ergebnisse könnten als Basis für weitere klinische Studien dienen und sind Beleg für das große Potential der Präzisionsonkologie.
Die Prognose von fortgeschrittenen Gallenwegstumoren ist trotz der Zulassung von zielgerichteten Therapien nach wie vor bescheiden. „Ein Grund dafür ist, dass die Wirksamkeit von Chemotherapien sehr limitiert ist und nur ein relativ geringer Anteil der Betroffenen mit zielgerichteten Wirkstoffen, z.B. auf Basis von nachgewiesenen FGFR2 Genfusionen oder IDH Mutationen, versorgt werden können. „Daher haben wir uns auf die Suche nach neuen genetischen Angriffspunkten gemacht, letztlich um neue therapeutische Möglichkeiten auszuloten.“ schildert Studienleiter Andreas Seeber. Diese Ergebnisse sind nun im Fachjournal NPJ Precision Oncology (Nature) veröffentlicht worden.
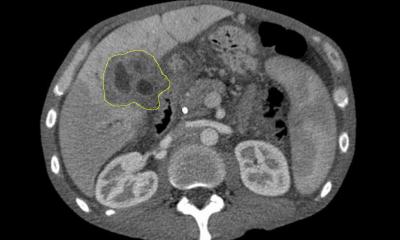
In einer weltweiten Kooperation im Rahmen der „Precision Oncology Alliance“ konnte unter Führung der Innsbrucker Krebsforscher um Andreas Seeber, Kai Zimmer und Florian Kocher das molekulare Profil von Gallenwegstumoren detailliert charakterisiert werden. Anhand einer Kohorte von mehr als 1.800 Patienten wurde eine Mutation im Polybromo-1 (PBRM1) in zirka 8% der Patienten nachgewiesen. „Was speziell diese Mutation als neuen therapeutischen Angriffspunkt interessant macht, ist die Tatsache, dass ein Funktionsverlust dieses Gens mit einer reduzierten Reparaturkapazität von vorgeschädigter DNA einhergeht.“ erklärt Dominik Wolf. PARP- und ATR-Inhibitoren sind zielgerichtete Substanzen, welche die zellulären DNA-Reparaturmechanismen blockieren und somit zur Apoptose (Zelltod) der Krebszellen führen. Dies wird auch als „Synthetische Letalität“ bezeichnet. Bis dato konnte die klinische Wirksamkeit dieses Konzepts zum Beispiel bei Brust-, Eierstock-, Bauchspeicheldrüsen- und Prostatatumoren belegt werden.
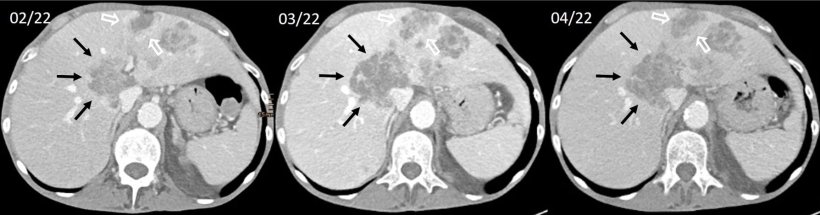
Bildquelle: Zimmer et al., NPJ Precision Oncology 2023 (CC BY 4.0)
Die Wissenschafter konnten diese Beobachtung durch In-vitro-Experimente bestätigen: Die kombinierte Gabe von PARP- und ATR-Inhibitoren ist in PBRM1-mutierten Zelllinien hoch wirksam und induziert „Synthetische Letalität“ der Krebszellen. „Unsere Untersuchungen können künftig als Grundlage für die klinische Testung von PARP- und ATR-Inhibitoren bei dieser speziellen Subgruppe an PatientInnen im Rahmen von klinischen Studien dienen“, sagt Kai Zimmer. In der Innsbrucker Klinik wurde bereits bei einem Patienten mit einem weit fortgeschrittenen Gallengangkarzinom mit PBRM1 Mutation eine PARP-Inhibitor Therapie eingesetzt. Kocher bestätigt, dass „die Lebensqualität des Patienten unter dieser experimentellen Therapie verbessert werden“ konnte.
Aus Sicht der Innsbrucker Forscher liegt in der genauen molekularen Charakterisierung von Tumoren ein großes Potential, die zu einer Verbesserung der Behandlungsmöglichkeiten von Krebspatienten führen können. Seit mittlerweile drei Jahren ist am Campus der Medizinischen Universität Innsbruck das Molekulare Tumorboard etabliert, wo fächerübergreifend individualisierte Therapiestrategien anhand genetischer und transkriptioneller Tumorprofile erarbeitet werden. Diese Empfehlungen kommen dann im optimalen Fall umgehend den Patienten zugute. „Die Komplexität der Ergebnisse molekularer Analysen benötigt aber ein hohes Maß an interdisziplinärer Kooperation von KlinikerInnen verschiedener Fachdisziplinen, MolekularpathologInnen, PathologInnen, HumangenetikerInnen und Grundlagen-WissenschafterInnen“, schildert Wolf.
Quelle: Medizinische Universität Innsbruck
07.07.2023