News • Bösartiger Krebs im Kindesalter
Neuroblastom: Forscher bringen Tumorzellen auf Kollisionskurs
Mit zwei marktverfügbaren Hemmstoffen lässt sich bei Neuroblastomen der Zellzyklus der Krebszellen an einer Schlüsselstelle so stören, dass die Tumorzellen sterben.
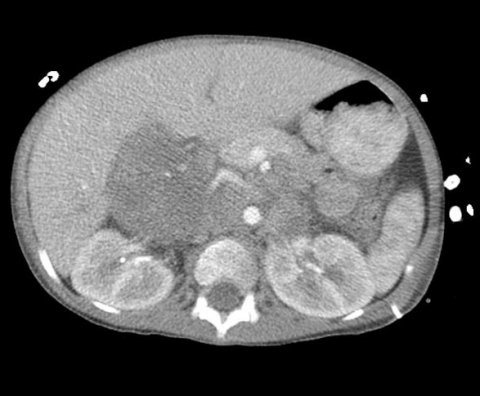
Bildquelle: RadsWiki, Neuroblastoma 101, CC BY-SA 3.0
Neuroblastome sind bösartige solide Tumoren, die vor allem im frühen Kindesalter auftreten. Sie entstehen aus entarteten unreifen Zellen des sympathischen Nervensystems. Ein Anhaltspunkt, mit dem sich die Bösartigkeit des Tumors abschätzen lässt, ist das MYCN-Onkogen. Hochrisikopatienten des Neuroblastoms haben oft sehr hohe Mengen dieses Proteins, was das unkontrollierte Tumorwachstum antreibt. Im Umkehrschluss könnte die Hemmung von MYCN oder seiner Funktion eine aussichtsreiche Therapiechance sein.
Einen wichtigen Schritt auf diesem Weg leistete eine kürzlich in der Zeitschrift Nature Cancer veröffentlichte, internationale Forschungsarbeit unter Leitung von Wissenschaftlern der Julius-Maximilians-Universität Würzburg (JMU).
Ko-Letztautorin der Publikation ist Dr. Gabriele Büchel vom Lehrstuhl für Biochemie und Molekularbiologie am Biozentrum der JMU. Die Arbeitsgruppenleiterin erläutert: „Bislang wusste man, dass MYCN die Funktion der RNA-Polymerase kontrolliert. Diese liest im Zellkern die DNA ab und stellt daraus die mRNA her. Durch unsere Forschungsarbeit konnten wir zeigen, dass MYCN außerdem eine spezifische Rolle während der S-Phase des Zellzyklus spielt, in der die DNA auch verdoppelt wird.“ In dieser Phase finden also zwei Prozesse gleichzeitig statt: das Ablesen und die Replikation der DNA. Bildlich gesprochen sind laut Gabriele Büchel „zwei Züge auf demselben Gleis unterwegs“.
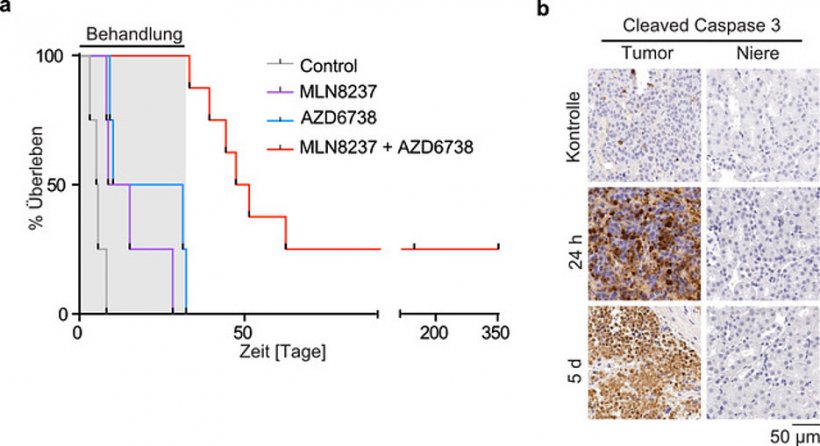
Bild: Gabriele Büchel / Universität Würzburg
Zusammen mit der Doktorandin Isabelle Roeschert fand sie heraus, dass MYCN Kollisionen beider Züge – sogenannte Transkriptions-Replikations-Konflikte – verhindert. Für diese Signalwirkung sind die zwei Enzyme Aurora-A und ATR notwendig, die man beide mit vorhandenen Pharmaka hemmen kann. Auf diese Weise können gezielt „Zugkollisionen“ herbeigeführt werden, um die Tumorzelle zu schädigen. Oder medizinisch ausgedrückt: Die Kombination beider Wirkstoffe führt zu DNA-Schäden und Zelltod – und zwar hochspezifisch in Tumoren, während andere Gewebe unbeeinflusst bleiben. „In Mausmodellen des Neuroblastoms konnten wir durch diese Strategie eine Regression des Tumorwachstums erreichen. Ein Teil der Versuchstiere konnte mit dieser Strategie geheilt werden“, verdeutlicht Gabriele Büchel den Effekt dieser „Therapie“.
Nach ihren Angaben könnten auch Patienten zeitnah von den gewonnenen Erkenntnissen profitieren. „Die von uns eingesetzten Substanzen sind alle bereits auf dem Markt. Aurora-A- und ATR-Inhibitoren sowie die von uns eingesetzten Kombinationen werden zurzeit in einer Reihe von praxisnahen Modellen geprüft. Wenn sie da erfolgreich sind, könnten bald klinische Studien beginnen“, kündigt Büchel an.
Quelle: Julius-Maximilians-Universität Würzburg
12.02.2021