Medizintechnik
Molekularen Maschinen bei der Arbeit zusehen
Ein internationales Team unter Beteiligung des Forschungsinstituts für Molekulare Pathologie (IMP) in Wien kombinierte neueste Methoden der Elektronenmikroskopie und der Proteinsynthese und erreichte eine neue Dimension in der Darstellung von Molekülen.
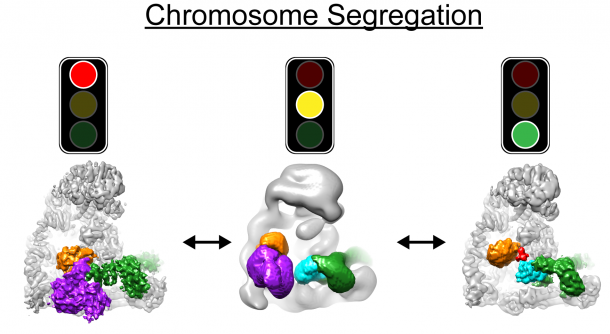
Alle Lebensformen der Erde pflanzen sich durch Teilung fort. Wenn sich Zellen teilen, müssen sie sicherstellen, dass ihre Nachkommen alle lebenswichtigen Inhalte erben. Am wichtigsten ist die korrekte Aufteilung und Weitergabe der genetischen Information, der DNA. Wenn bei diesem Schritt Fehler passieren und zu viele oder zu wenige Chromosomen in der Tochterzelle landen, bedeutet das oft den Tod dieser Zelle. Im schlimmeren Fall können Chromosomen-Abweichungen zur Entstehung von Krebs beitragen oder zu Fehlbildungen wie beim Down-Syndrom führen.
Die korrekte Aufteilung der Chromosomen ist ein wichtiger Schritt im Ablauf der Zellteilung und wird durch große, komplex aufgebaute Moleküle ausgeführt. Eine dieser „molekularen Maschinen“ wurde nun von einem internationalen Forscherteam in Österreich, Deutschland und den USA mit neuen Methoden untersucht und detailliert beschrieben.
Mikroskopie in nie dagewesener Auflösung
Molekulare Maschinen führen vielfältige und anspruchsvolle Aufgaben innerhalb der Zellen aus. Wie von Menschen erschaffene Maschinen sind sie meist aus zahlreichen Elementen aufgebaut. Während ein Techniker ein solches Werk durch genaue Betrachtung oder durch Zerlegen in die Einzelteile begreifen kann, ist dieses Vorgehen im molekularen Bereich ungleich schwieriger. Selbst große Moleküle bringen es auf kaum mehr als ein Zehntausendstel eines Millimeters – eine extreme Hürde für Forscher, die diese Moleküle untersuchen.
„Wären molekulare Maschinen sichtbar, so könnten wir ihre Funktionsweise viel eher verstehen“, meint auch Jan-Michael Peters, Direktor des Wiener Forschungsinstituts für Molekulare Pathologie (IMP) und einer der führenden Wissenschaftler im Team, das sich mit der Chromosomen-Segregation befasst. Nun ist dieser Wunsch Realität geworden. Eine am IMP entwickelte Technik erlaubt es, die großen Moleküle synthetisch herzustellen und durch gezielte Manipulation auf ihre Funktion zu schließen. Die Methode erweist sich auch bei anderen Eiweißkomplexen als nützlich und wird bereits an Labors weltweit vertrieben.
Das Forschungsteam kombinierte diese Methode mit einer weiteren Neuerung im Bereich der Elektronenmikroskopie, die Auflösungen im atomaren Bereich erlaubt. Die Proben werden dazu bei sehr tiefen Temperaturen gefroren und mit Elektronenstrahlen abgetastet, deren Detektoren mit nie dagewesener Präzision messen. Auf diese Weise gelingt es tatsächlich, Eiweißmoleküle sichtbar zu machen, deren Durchmesser weniger als ein Hundertstel eines menschlichen Haares beträgt. Die Arbeiten am Elektronenmikroskop wurden im Labor von Holger Stark am Max Planck Institut für Biophysikalische Chemie in Göttingen durchgeführt.
Molekülkomplex schaltet sich selbst an
Neben den Forschern in Wien und Göttingen war auch Brenda Schulman vom St. Jude Children’s Research Hospital in Memphis an der Kooperation beteiligt. Mit Hilfe der neuen Techniken konnte das Team einen Komplex mit der Bezeichnung APC/C aufklären. „APC/C ist wichtig, weil es die Aufteilung der Chromosomen bei der Zellteilung einleitet“, erläutert Jan-Michael Peters. „Und zwar erst, wenn alle anderen notwendigen Schritte abgeschlossen sind. Wäre das nicht so, würden laufend Zellen mit falschen Chromosomenzahlen entstehen – mit katastrophalen Folgen. Wir wussten aber bisher nicht, wie der APC/C-Komplex zum richtigen Zeitpunkt aktiviert wird.“
Durch die Zusammenarbeit der drei Forschergruppen war es möglich, die APC/C-Maschine vor und nach der Aktivierung sichtbar zu machen. „Interessanterweise fanden wir, dass APC/C sich selbst anschalten kann - etwa so, wie ein Hybridauto selbstständig vom elektrischen in den Benzinantrieb schaltet und umgekehrt“, kommentiert Brenda Schulman die Ergebnisse. „In Zukunft werden wir molekulare Prozesse in einer Detailtreue darstellen und verstehen können, wie wir es uns bisher nur erträumt haben“, ergänzt Holger Stark.
Längerfristig, so hoffen die beteiligten Wissenschaftler, wird ihre Arbeit dazu beitragen, fehlerhafte Chromosomenverteilungen und die daraus resultierenden Erkrankungen besser zu verstehen und womöglich zu verhindern.
Quelle: IMP - Forschungsinstitut für Molekulare Pathologie GmbH
24.08.2016