Artikel • Neuropathologie
Glioblastom: 3D-Tumororganoide zeigen, ob die Therapie wirkt
Am Universitätsklinikum Regensburg besteht mit dem Zentrum für Hirntumoren (ZHT) und der angeschlossenen Wilhelm-Sander-Therapieeinheit NeuroOnkologie eine der größten und modernsten Einrichtungen für die Behandlung von Hirntumoren in Deutschland. Ein wichtiger Partner des interdisziplinären Therapie- und Forschungsteams ist Prof. Dr. Markus Riemenschneider, Leiter der Abteilung für Neuropathologie. Seinem Forschungsansatz ist es zu verdanken, dass Patienten mit einem Glioblastom neue Hoffnung auf ein längeres Überleben bei der Behandlung des malignen und besonders invasiven Hirntumors haben können.
Bericht: Brigitte Dinkloh

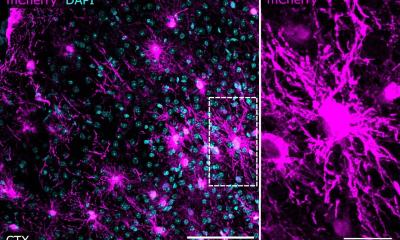
Dabei werden Tumorzellen des Glioblastom in vitro gezüchtet, die sich wie Tumorzellen im menschlichen Körper verhalten. „Diese Tumororganoide ermöglichen uns, die Prozesse beim Tumorwachstum besser zu verstehen und eines Tages ggf. auch das individuelle Therapieansprechen von Medikamenten im Sinne einer personalisierten Medizin erproben zu können,“ schildert Professor Dr. Markus Riemenschneider, Leiter der Abteilung für Neuropathologie am UKR.
Molekulare Veränderungen in den Zellen interessieren die Forscher am ZHT schon seit langem. Deshalb werden die bei einer Operation entnommenen Tumorzellen mit Einwilligung des Patienten in einer Zellkultur angezüchtet. Bislang bestand dabei das Problem, dass die Heterogenität der Zellen nicht erhalten bleiben konnte, sondern die Zellen gleichgeschaltet wurden.

Prof. Riemenschneider: „Es ist charakteristisch für das Glioblastom, dass der Tumor eine relativ große Heterogenität hat. Es gibt verschiedene Zellen, die im Tumor koexistieren, die einen sind z.B. eher hypoxisch, die anderen normoxisch, d.h. der Sauerstoffgehalt unterscheidet sich; weiterhin gibt es Nekrosezonen und Zonen, die besser durchblutet sind. Dadurch sind viele verschiedene Tumorzellen mit unterschiedlichen genetischen Programmen aktiv. Und werden diese Zellen entnommen und in der herkömmlichen Zellkultur angezüchtet, dann hat man nur eine Bedingung und die Vielgestaltigkeit geht verloren.“
Doch diese Beschränkung kann jetzt mit Hilfe der neuen 3D Organoidmodelle geknackt werden. Es gibt bislang nur wenige Studien dazu, vorrangig bei gastrointestinalen Tumoren und beim Kolonkarzinom. Aber gerade für die Erforschung des Glioblastoms ist dieses Modell wichtig, weil dabei die Zellen im Verband weiterwachsen, untereinander interagieren und sich wie im eigentlichen Tumor in verschiedene Funktionen ausdifferenzieren können. „Erreicht wird dies mit einer extrazellulären Matrix, die den Zellen ein Gerüst vorgibt, an dem sich die Zellen festsetzen können, die dann aber mit der Zeit verstoffwechselt wird, den Zellen aber die gefundene Struktur und Integrität belässt. Das gibt uns die Hoffnung, dass wir die Situation im Patienten realistischer modellieren können, die Gradienten abbilden können, z.B. im Hinblick auf Sauerstoffsättigung und Nährstoffversorgung und dadurch noch ganz andere Dinge sichtbar werden, als in der normalen Zellkultur“, erklärt der Neuropathologe.

Bei den Tumororganoiden gibt es auch keine Speziesbarrieren und Artefakte, wie sie z.B. bei der Forschung mit Tumorzellen auftreten, die in Mäusegehirne implantiert werden. Und auch interindividuelle Barrieren entfallen, wenn ein rein autologes Setting besteht. Dank der Forschung im Verbund mit der Universität Erlangen können aber nicht nur die Tumororganoide in der Petrischale erstellt werden, sondern sogar kleine Minigehirne. Grundlage hierfür ist das 2012 mit dem Nobelpreis für Medizin ausgezeichnete Verfahren, wonach sich aus gesunden Körperzellen über induzierte pluripotente Stammzellen alle Zellen des menschlichen Körpers differenzieren lassen. „Es eröffnet uns ganz neue Perspektiven, die gezüchteten Tumorzellen der Patienten mit den körpereigenen Minigehirnen konfrontieren zu können und dann zu schauen, wie die Tumorzellen in die Gehirnzellen einwachsen, welche Faktoren in dem Zusammenspiel zwischen gesund und krank eine Rolle spielen und in der Zukunft dann auch einmal therapeutisch Einfluss zu nehmen“, so Prof. Riemenschneider
Derzeit steht das Forschungsprojekt noch in seinen Anfängen, aber es besteht natürlich das langfristige Ziel, das Verfahren so weit zu standardisieren, dass z.B. das Ansprechen auf Medikamente getestet und ein Wirksamkeitsnachweis in der individuellen Patientensituation erbracht werden kann. Die hierbei gewonnen Erkenntnisse könnten auch bei der Therapie seltener Hirntumore eine Rolle spielen, die in herkömmlichen Zellkulturen nicht gut zu untersuchen sind. Es braucht für die Hirntumoren eine sehr differenzierte Betrachtungsweise, da es über 100 verschiedene Typen von Hirntumoren gibt. Dass sich dieses Vorgehen, wie es in der Wilhelm-Sander-Therapieeinheit praktiziert wird, auszeichnet, zeigt der kontinuierliche Anstieg der Lebenserwartung der Patienten seit der Gründung des Zentrums. „Auch wenn das Glioblastom weiterhin prognostisch relativ ungünstig ist, so konnte die durchschnittliche Überlebenszeit der Patienten im Zentrum deutlich erhöht werden. Das spricht dafür, dass Patienten immer gut beraten sind, an spezialisierte Zentren zu gehen. Unser Ziel ist es, mehr Überlebenszeit bei guter Lebensqualität für den Patienten herauszuholen“, hofft Prof. Riemenschneider. Ein erster Ansatz dafür ist in Regensburg jetzt gemacht. Denn bei ausgewählten Patienten steht zwei bis drei Monate nach der Operation eine Tumororganoidkultur bereit, so dass bei einem Rezidiv die Sensitivität des Tumors auf bestimmte Medikamente vorab im Labor geprüft werden kann.
Profil:
Prof. Dr. Riemenschneider ist seit 2010 Universitätsprofessor und Leiter der Abteilung für Neuropathologie am Universitätsklinikum Regensburg. Nach dem Medizinstudium und der Promotion in Düsseldorf wurde er an eben dieser Universität zum Neuropathologen ausgebildet. Mit einem Mildred-Scheel-Stipendium der Deutschen Krebshilfe forschte er am Department of Pathology des Massachusetts General Hospital und der Harvard Medical School, Boston, USA. 2008 erlangte er die Facharztanerkennung für das Fach Neuropathologie und bis zur Berufung nach Regensburg war er Leiter einer eigenständigen Max-Eder-Nachwuchsarbeitsgruppe der Deutschen Krebshilfe am Institut in Düsseldorf. Sein wissenschaftliches Interesse gilt der molekularen Neuroonkologie. Für seine Forschungen wurde er unter anderem mit der Berufung in das Junge Kolleg der Nordrhein-Westfälischen Akademie der Wissenschaften und der Künste und dem Sibylle Assmus Förderpreis 2011 für Neuroonkologie ausgezeichnet. Prof. Riemenschneider ist außerdem sehr um die Qualitätssicherung in der Neuropathologie bemüht. In dieser Funktion ist er als Fachbegutachter der Deutschen Akkreditierungsstelle (DAkkS) und als wissenschaftliches Beiratsmitglied der Qualitätssicherungsinitative in der Pathologie (QuIP) GmbH in Berlin tätig.
24.04.2019