Die Aussichten für MR-PET sind blendend – wenn Geld und Infrastruktur stimmen
Der Heidelberger Professor Heinz-Peter Schlemmer fordert, die molekulare Bildgebung verstärkt im klinischen Bereich zu etablieren. Nur wenige Krebszentren aber haben dafür die Ressourcen.

Die Radiologie muss künftig verstärkt belegen, dass die molekulare Bildgebung den klinischen Bereich voranbringt. Davon ist Professor Heinz-Peter Schlemmer, Mediziner, Physiker und Leiter der Abteilung Radiologie im Deutschen Krebsforschungszentrum in Heidelberg, überzeugt. „Wir müssen die Infrastrukturen für die molekulare Bildgebung im klinischen Bereich schaffen. Sonst bleiben wir bei den Tierversuchen in der Präklinik stecken und können die Erkenntnisse nicht auf die Behandlung von Menschen übertragen“, sagt Schlemmer. Der Einsatz von Hybridgeräten, die Magnetresonanz- und Positronenemissionstomografie (MR-PET) verbinden, biete sich als hochsensitive Diagnostik für diesen Forschungsbereich geradezu an.
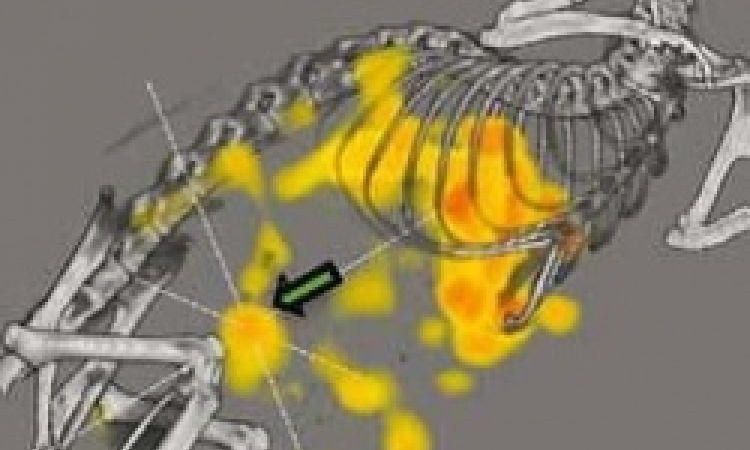
Die molekulare Bildgebung will die Eigenschaften der Moleküle oder deren Interaktion sichtbar machen. Vor allem die sogenannte personalisierte Medizin wird davon profitieren. Mediziner und Wissenschaftler, die sich diesem Ansatz verschrieben haben, setzen darauf, ihren Patienten in Zukunft nahezu maßgeschneiderte Therapien anbieten zu können. Grundlegend dafür ist eine spezielle Diagnostik im Vorfeld. Sie soll jene Patienten identifizieren, deren Krankheitsbild eine bestimmte molekulare Struktur einschließt, um sie gezielt mit therapeutischen Tracern zu behandeln. Um die Eigenschaften von Molekülen sichtbar zu machen und die entsprechenden Targets – also Zielmoleküle, die auf Wirkstoffe oder Strahlen reagieren – zu identifizieren, sind diagnostische Verfahren mit hoher Empfindlichkeit nötig. Das MR-PET erscheint Experten dafür am besten geeignet. Schließlich ermöglicht es eine schonende Untersuchung des Patienten und liefert dennoch aussagekräftige Ergebnisse. So lassen sich mithilfe der MRT wichtige Informationen beispielsweise zur Bewegung eines Tumors gewinnen, ohne dass die Patienten einer Strahlung ausgesetzt sind. Auch bei einer Kombination mit der PET bleibt die Strahlenexposition gering. Gerade bei Krebspatienten, die öfters untersucht werden müssen, um den Krankheitsverlauf zu dokumentieren, ist dies ein großer Vorteil.
Der Wert der Zusatzinformationen aus einer MR-PET hängt, so Schlemmer, stark davon ab, welches Radiopharmakon dem Patienten verabreicht wird. „Die Injektion spiegelt den speziellen Kontrast wider, den man erzielt, sei es aufgrund von Stoffwechseleigenschaften, sei es aufgrund der Dichte spezieller Oberflächenrezeptoren, die erkannt werden“, erklärt Schlemmer. Wenn es um die Auswahl des Radiopharmakons geht, ist der Handlungsspielraum der Mediziner und Forscher bislang jedoch begrenzt. Neben den wissenschaftlichen Arbeiten sind, so Schlemmer, viele behördliche Hürden zu überwinden: Das Arzneimittelgesetz schreibt vor, welche Zulassungsverfahren notwendig sind und wie ein Radiotracer in der Klinik zu testen ist. „Das erfordert eine Infrastruktur in der Radiopharmazie, die sehr kostenintensiv ist. So genannte Good Manufacturing Practice oder GMP-Einheiten müssen aufgebaut werden, um Radiotracer lokal herzustellen. Der Aufwand und die Kosten dafür sind enorm. Nur wenige Einrichtungen in Deutschland können sich das leisten“, erläutert Schlemmer.
Die Investition könnte sich jedoch lohnen. Schließlich gibt es im präklinischen Bereich bereits viele Erfolge. „In Experimenten mit Kleintieren werden laufend neue spannende Targets identifiziert und entsprechende Schlüsselmoleküle produziert, die auch im Tierexperiment evaluiert werden. Speziell geht es um die Sensitivität und Spezifität der Bindungseigenschaften der Moleküle, um diese in den klinischen Ablauf zu translationieren“, sagt Schlemmer. Ein Ausweg sei es, sich in verschiedenen Forschungseinrichtungen abgestimmt speziell auf bestimmte Krankheitsbilder zu konzentrieren. Er selbst beschäftigt sich seit Jahren mit der Diagnostik und Therapie des Prostatakarzinoms. Die Krankheit zählt zu den häufigsten Tumoren der westlichen Welt und ist in ihrer Aggressivität extrem variabel: „Es gibt niedrigmaligne Typen, die möglicherweise nie innerhalb der Lebenszeit in Erscheinung treten, aber auch hochaggressive Varianten, die schnell metastasieren, viel Leiden verursachen und innerhalb kürzester Zeit zum Tod führen. Wir haben hier einen enormen Bedarf an Früherkennung und auch Stratifizierung der Patienten.“
Notwendig ist es, die Forschung im Bereich der Bildgebung mit molekularbiologischen Untersuchungen zu verbinden. Das bedeutet auch, so Schlemmer, nach genetischen Markern und Zielmolekülen an den Membranoberflächen der Zellen zu suchen, um so die Patienten nach ihren Risiken zu stratifizieren: „Das ist ein umfangreiches Projekt, das enorme Ressourcen bindet. Sinnvoll ist es meiner Ansicht nach, diese Forschung an bestimmten Krebszentren zu konzentrieren und dort alle Energie einzusetzen.“
####
Im Profil
Prof. Dr. med. Dipl.-Phys. Heinz-Peter Schlemmer leitet seit Anfang 2010 die Abteilung Radiologie
des Deutschen Krebsforschungszentrums (DKFZ) in Heidelberg. Der Arzt und Physiker kehrt damit an den
Ort seiner medizinischen Aus- und Weiterbildung zurück. Am DKFZ liegen seine Forschungsschwerpunkte bei der Früherkennung von Prostata-, Kolon- und Lungenkrebs sowie in der Weiterentwicklung funktioneller Bildgebungsverfahren zur Tumorcharakterisierung und zum Therapiemonitoring.
Prof. Schlemmer war zuletzt in der Abteilung Diagnostische Radiologie des Universitätsklinikums Tübin-gen tätig und als Leitender Oberarzt für den Bereich Magnetresonanztomografie verantwortlich. In
Tübingen war er maßgeblich an der technischen Entwicklung des weltweit ersten Ganzkörper-MRT beteiligt.
09.05.2012