Festkörper-NMR
Bis aufs Atom: Bakterienskelett in der Nahaufnahme
Bakterien galten lange Zeit als primitive Gebilde, erst durch modernste Bildgebung hat man ihre innere Feinstruktur entdeckt. Dem Berliner Biophysiker Adam Lange ist es nun gelungen, ganz nah heranzuzoomen: Mit Hilfe einer neuen Technik der Strukturaufklärung konnte er den Grundbaustein eines Bakterienskeletts bis ins atomare Detail darstellen. Das von seinem Team untersuchte Bactofilin kommt nur bei Bakterien vor und könnte somit zum Ansatzpunkt für neue Antibiotika werden.
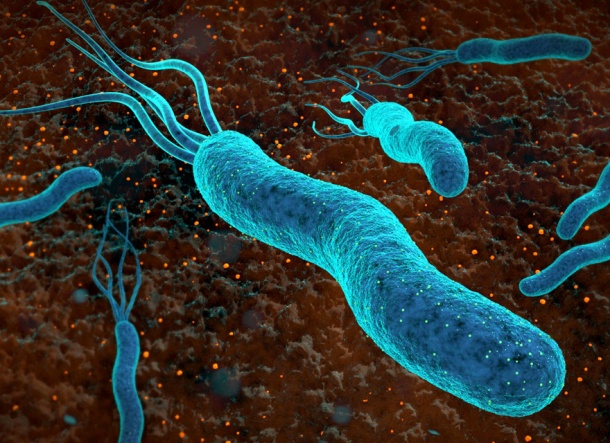
Das erst vor fünf Jahren entdeckte Bactofilin findet man unter anderem im Bakterium Helicobacter pylori, das für einen Großteil der Magengeschwüre verantwortlich ist. Während man früher davon ausging, dass Bakterien über kein stabilisierendes Zytoskelett verfügen, weiß man heute, dass auch die Winzlinge von komplexen Architekturen durchzogen werden, ähnlich wie die größeren und evolutionär gesehen moderneren Zellen von Pflanzen und Tieren. Durch Bactofilin erhält Helicobacter pylori seine typische schraubenförmige Gestalt, dank der sich das Bakterium durch die schützende Schleimschicht der Mageninnenwand bohren kann. Die einzelnen Bactofilin-Moleküle polymerisieren im Inneren der Bakterien spontan zu feinsten Fasern und höher geordneten Strukturen. Dabei spielt ein ungewöhnliches Strukturmotiv eine Rolle, wie das Team von Adam Lange am Leibniz-Institut für Molekulare Pharmakologie (FMP) schon in einer Anfang des Jahres veröffentlichten Arbeit herausgefunden hatte. Es handelt sich um die sogenannte Beta-Helix, die man nie zuvor in einem Zytoskelett gefunden hatte. Die Bactofilin-Moleküle ähneln in ihrer Form Spiralnudeln mit sechs Windungen, bei der Polymerisation lagern sie sich weiter zu langen, extrem dünnen Fasern aneinander.
Die Untersuchung solcher Faserproteine ist eine Herausforderung für Strukturbiologen, da sie sich weder in Flüssigkeit lösen noch auskristallisieren lassen, wie es für die gängigen Untersuchungsmethoden notwendig ist. Die beiden Erstautoren der Arbeit, Chaowei Shi und Pascal Fricke, setzten daher die relativ junge Festkörper-NMR ein, und das außerdem in einer neuen, am FMP entstanden Weiterentwicklung, die eine besonders hohe Auflösung ermöglicht. NMR steht für „Nuclear magnetic resonance“, auf Deutsch Kernspinresonanz. Diese beruht auf der Eigenschaft mancher Atomkerne, in einem starken äußeren Magnetfeld selbst zu kleinen Magneten zu werden. Anhand ihrer charakteristischen Resonanz mit Radiowellen kann man durch komplizierte Rechenverfahren die Lage der Atome innerhalb von Molekülen ermitteln. Das Besondere an der Festkörper-NMR besteht darin, dass die Probe im Magnetfeld sehr schnell rotiert, um die Bewegungen gelöster Moleküle zu simulieren.
Da man nun die exakte Form der Bactofilin-Bausteine und ihre chemischen Eigenschaften kennt, kann man nach kleinen Molekülen fahnden, die die Polymerisierung der Fasern stören. Auf diese Weise könnte man Wirkstoffe entwickeln, die spezifisch bestimmte Bakterien abtöten. Die Bactofilinfasern durchziehen dabei nicht nur das Innere von Helicobacter – im harmlosen Caulobacter crescentus bilden die Fasern sogar eng verwobene Matten aus. Diese Matten sind das Fundament für einen langen Stiel, mit dem die Bakterien sich an Oberflächen anheften oder Nahrung aufnehmen können.
„Alle Vorgänge in lebenden Organismen werden letztlich von Proteinen angetrieben, und um zu verstehen, wie sie funktionieren, müssen wir ihre Strukturen kennen“, sagt Adam Lange. Der Biophysiker gehört zu einem der weltweit führenden Experten auf dem Gebiet der Festkörper-NMR, möchte künftig aber die Kombination verschiedener Techniken vorantreiben. „Auch auf dem Gebiet der Kryoelektronenmikroskopie gab es in den letzten Jahren beeindruckende Durchbrüche, hier wollen wir Kooperationen bilden“, sagt Lange. „Will man Proteinstrukturen in all ihren Dimensionen und Details verstehen, darf nicht jeder Experte für sich allein arbeiten, vielmehr müssen wir die modernen machtvollen Techniken in gemeinsame Projekte integrieren.“
Literatur: Chaowei Shi*, Pascal Fricke*, Lin Lin, Veniamin Chevelkov, Melanie Wegstroth, Karin Giller, Stefan Becker, Martin Thanbichler, and Adam Lange: Atomic-resolution structure of cytoskeletal bactofilin by solid-state NMR. Science Advances, 04 Dec 2015, Vol. 1, no. 11, e1501087, DOI: 10.1126/sciadv.1501087
*gleichberechtigte Erstautoren
Quelle: Leibniz-Institut für Molekulare Pharmakologie
04.01.2016