© Wiley-VCH; aus: Corzana F et al, Angewandte Chemie 2024 (CC BY 4.0)
News • Glykopeptid-Sonden zur Autoantikörper-Detektion in Blutproben
Bauchspeicheldrüsenkrebs: Neue Technik verbessert Früherkennung
Bauchspeicheldrüsenkrebs ist eine der tödlichsten Krebserkrankungen weltweit, vor allem aufgrund der meist erst sehr späten Diagnose, denn die gängigen Marker sind für Screenings zur Früherkennung zu unempfindlich und zu unspezifisch.
Ein Forschungsteam stellt jetzt in der Zeitschrift Angewandte Chemie einen neuen Ansatz vor, der zu einer wesentlich genaueren, verlässlicheren Diagnostik führen könnte. Er basiert auf dem selektiven Nachweis spezifischer Antikörper in Blutproben.
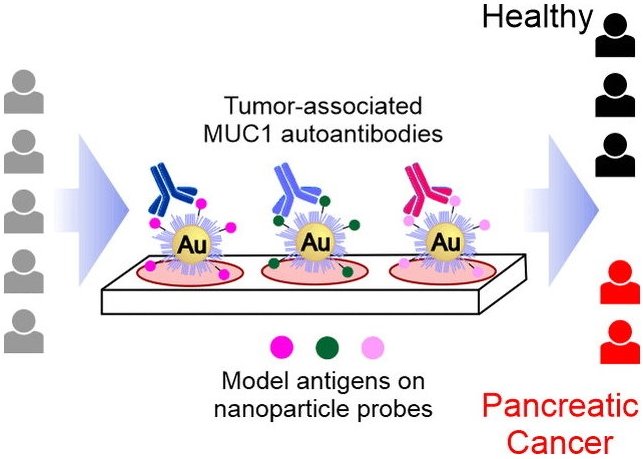
Tumore produzieren bestimmte Proteine (Tumor-assoziierte Antigene) die unserem ständig „patrouillierenden“ Immunsystem auffallen und eine Immunantwort auslösen können. In Folge werden dagegen gerichtete Antikörper (Tumor-assoziierte Autoantikörper) gebildet, die bereits in einem sehr frühen Stadium der Krankheit im Blut zirkulieren – und zur Früherkennung genutzt werden können. Ein internationales Team um Roberto Fiammengo und Giovanni Malerba von der Universität Verona (Italien) sowie Alfredo Martínez vom Zentrum für Biomedizinische Forschung in La Rioja (Logroño, Spanien) und Francisco Corzana von der Universität von La Rioja hat jetzt einen Ansatz für einen diagnostischen Test für Bauchspeicheldrüsenkrebs entwickelt, der auf der Detektion solcher speziellen Tumor-assoziierten Autoantikörper basiert.
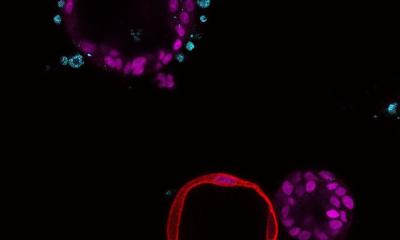
© Wiley-VCH; aus: Corzana F et al, Angewandte Chemie 2024 (CC BY 4.0) Erstellt mit BioRender.com
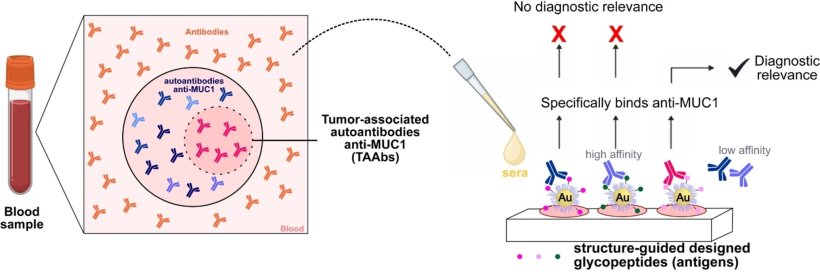
Die Wahl fiel auf Autoantikörper, die sich gegen die Tumor-assoziierte Form von Mucin-1 (TA-MUC1) richten. Mucin-1 ist ein stark glykosyliertes Protein (Eiweiß mit Zuckerbausteinen), das z.B. in Drüsengewebe vorkommt. In vielen Tumorarten wie Bauchspeicheldrüsenkrebs liegt es in deutlich erhöhter Konzentration vor – zudem ist das Zuckermuster gegenüber der normalen Form verändert. Ziel des Teams war, Autoantikörper zu detektieren, die sich spezifisch gegen TA-MUC1 richten und ein klares Indiz für Bauchspeicheldrüsenkrebs sind.
Ausgehend von Strukturanalysen und Computersimulationen bekannter Antikörper gegen TA-MUC1 (SM3 und 5E5) designte das Team eine Sammlung synthetischer Glykopeptide, die verschiedene Bereiche (Epitope) von TA-MUC1 nachahmen. Dabei wurden auch unnatürliche Modifikationen vorgenommen, um die Chancen zu erhöhen, Autoantikörper-Untergruppen zu identifizieren, die die Krankheit anzeigen. Das Team immobilisierte diese Modellantigene auf Goldnanopartikeln und erhielt so Sonden, die für einen serologischen Test (Dot-Blot-Assay) geeignet sind. Der diagnostische Assay wurde mit echten Proben von Patienten mit Bauchspeicheldrüsenkrebs und einer gesunden Kontrollgruppe validiert. Einige der Nanopartikelsonden konnten sehr gut zwischen Proben von erkrankten und gesunden Personen unterscheiden und zeigten so, dass sie tumorassoziierte Autoantikörper nachweisen. Bemerkenswert ist, dass diese spezifischen Autoantikörper ein deutlich besseres Verhältnis von richtig-positiv/falsch-positiv aufwiesen als aktuelle klinische Biomarker für Bauchspeicheldrüsenkrebs.
Sonden mit kleineren Glykopeptid-Antigenen, die nur einem einzelnen Epitop entsprechen, führten zu besseren Ergebnissen als mit größeren, die mehrere Epitope nachahmen – was den Vorteil eines geringeren synthetischen Aufwands hat. Ein kurzes Glykopeptid mit einer unnatürlichen Modifikation seiner Zuckerkomponente erwies sich als besonders wirksam für den Nachweis von unterscheidenden Autoantikörpern. Der neue strukturbasierte Ansatz könnte helfen, Autoantikörper-Untergruppen mit höherer Tumor-Spezifität zu selektieren.
Quelle: Gesellschaft Deutscher Chemiker
15.08.2024