News • Krebsforschung
Mit Lymphknoten-Analyse auf Metastasen-Jagd
Was macht eine Tumorzelle zu einer mörderischen Zelle? Das Fraunhofer-Institut für Toxikologie und Experimentelle Medizin ITEM erforscht die Mechanismen der Metastasen-Bildung und sucht Ansätze für neue Therapien im Kampf gegen Krebs. Unter anderem hat das Forscherteam des Fraunhofer ITEM eine Methode entwickelt, mit der sich komplette Lymphknoten analysieren lassen.

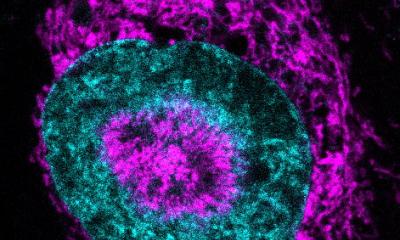
© Fraunhofer ITEM/P. Reinig
Einzelne, gestreute Tumorzellen können für Krebspatienten tödlich sein. Jahrelang schlummern sie im Knochenmark oder anderen Organen, um eines Tages Metastasen zu bilden, die schließlich zum Tod führen. Neun von zehn Krebstoten sterben nicht am Primärtumor, sondern an den Tochtergeschwülsten. "Wir entwickeln spezielle Methoden, um einzelne gestreute Tumorzellen genetisch zu analysieren und sie gezielt zu bekämpfen", erklärt Dr. Bernhard Polzer, stellvertretender Bereichsleiter im Forschungsbereich Personalisierte Tumortherapie des Fraunhofer ITEM in Regensburg. Anhand genetischer Daten will das 40-köpfige Forschungsteam Licht in den noch unverstandenen Prozess der Metastasenbildung bringen und so Ansätze für neue Therapieformen finden.
Dieser Artikel könnte Sie auch interessieren
Artikel • Verfahrensfragen
Ganzkörper-MRT bei Knochenmetastasen: unschlagbar, aber …
Knochenmetastasen gehören zu den schwerwiegendsten Spätkomplikation vieler Tumorerkrankungen. Lange galt die Skelettszintigraphie als Goldstandard zur Detektion solcher Knochenmetastasen. Doch Prof. Dr. Andrea Baur-Melnyk plädiert für die Ganzkörper-MRT, da sie „Knochenherde und Organmetastasierungen früher und besser erkennen kann“.
Großes Potenzial zur Vermeidung von Metastasen sieht Forschungsbereichsleiter Prof. Christoph Klein in einer Diagnostik, welche die beginnende Metastasierung molekular und zellbiologisch verstehen lernt. Wichtige Informationen hierzu können bei der pathologischen Untersuchung von Lymphknoten gewonnen werden, die während einer Tumoroperation entfernt wurden. Um zu sehen, ob der Tumor bereits gestreut hat, werden seit mehr als hundert Jahren aus dem Lymphknoten-Gewebe an mehreren Stellen hauchdünne Scheiben herausgeschnitten, in denen der Pathologe nach Krebszellen sucht. Allerdings wird das Gewebe zwischen den Schnittebenen nicht betrachtet. Dort vorhandene Metastasen werden daher übersehen.

© Fraunhofer ITEM/P. Reinig
Gemeinsam mit dem Fraunhofer-Institut für Produktionstechnik und Automatisierung IPA und dem Fraunhofer-Institut für Integrierte Schaltungen IIS hat das Team von Prof. Klein eine Methode entwickelt, mit der sich der gesamte Lymphknoten analysieren lässt. Zur Probenvorbereitung dient ein Gewebezerkleinerer (Tissue Grinder), der die Zellen schonend separiert. Danach wird die Probe mit einem speziellen Farbstoff behandelt, der die gestreuten Tumorzellen anfärbt. Zwei Millionen Lymphknoten-Zellen werden automatisch gescannt. Eine KI-basierte Bildauswertung identifiziert hochsensitiv die wirklichen Krebszellen unter jeglichen anderen gefärbten Objekten (Artefakten) wie z.B. Färbereste. "Mit unserer Methode haben wir bei der Hälfte der untersuchten Lymphknoten Tumorzellen nachgewiesen", berichtet Polzer. "Mit dem klassischen Verfahren konnten die Pathologen dagegen nur in 15 bis 20 Prozent der Proben Krebszellen finden." Zurzeit wird das Verfahren für den Markt entwickelt.
Wenn Brustkrebszellen im Knochenmark liegen, können sie die Eigenschaften der sie umgebenden blutbildenden Zellen annehmen. Offenkundig passen die Zellen sich an ihre Umgebung an
Christoph Klein
Nach der Isolation der einzelnen gestreuten Tumorzellen muss die DNA der Zellen vervielfältigt werden. Bei der genetischen Analyse lässt sich zum Beispiel erkennen, ob die gestreuten Tumorzellen die gleichen Eigenschaften haben wie der Primärtumor und daher auf die gleiche Behandlung ansprechen könnten. Oft ist das aber nicht der Fall. Die gestreuten Zellen verändern sich, wenn sie längere Zeit in einem fremden Gewebe leben. "Wenn Brustkrebszellen im Knochenmark liegen, können sie die Eigenschaften der sie umgebenden blutbildenden Zellen annehmen", berichtet Klein. "Offenkundig passen die Zellen sich an ihre Umgebung an." In ihrem neuen Umfeld können die gestreuten Zellen aber auch neue Krebsgene aktivieren. Dann werden sie immer aggressiver und gefährlicher. Wenn die genetische Analyse ergibt, dass sich die gestreuten Tumorzellen verändert haben, müssen sie mit anderen Mitteln bekämpft werden als der Primärtumor. Wie sich für jeden Patienten das geeignete Medikament finden lässt, wird von Polzer und Klein gerade erforscht.
Ausgangspunkt ist eine Technologie, die bereits bei großen Zellzahlen funktioniert und jetzt für Einzelzellen adaptiert wird. Analysiert werden dabei 450 krebstypische Mutationen, für die es bereits Medikamente auf dem Markt oder in klinischen Studien gibt. Dr. Polzer hat das Ziel klar vor Augen: "Wir wollen aus Lymphknoten oder Knochenmark die gestreuten Tumorzellen isolieren und sie auf die 450 Mutationen untersuchen. Dann könnten wir mit dem geeigneten Medikament die Bildung von Metastasen verhindern." Damit dieses Ziel erreicht wird, arbeiten die Regensburger Forscher mit verschiedenen Firmen zusammen, die diese innovative Diagnostik in den klinischen Alltag transferieren wollen.
Dieser Artikel könnte Sie auch interessieren

Artikel • Auf Tumorsuche
CUP-Syndrom: Rauch ohne Feuer
Das CUP-Syndrom (von engl. cancer of unknown primary) schickt Radiologen auf eine mitunter frustrierende Schnitzeljagd: Beim Patienten werden Metastasen entdeckt, doch vom Primärtumor fehlt jede Spur. Prof. Dr. Alwin Krämer erklärt, worauf Mediziner im Umgang mit CUP-Patienten achten müssen.
Doch längst nicht jede gestreute Zelle bildet auch Metastasen. Christoph Klein hat ausgerechnet, dass bei einer Brustkrebspatientin, die noch keine sichtbaren Metastasen hat, 10.000 bis 20.000 gestreute Krebszellen im Knochenmark vorkommen können. Nur ein paar davon haben das Potenzial, eine Metastase zu bilden. Aber was sind die Eigenschaften, die sie dazu befähigen?
Um eine Antwort auf diese Frage zu finden, hat Prof. Klein in Zusammenarbeit mit mehreren Kliniken eine Studie mit 200 Brustkrebspatientinnen gestartet. Von diesen Patientinnen untersucht sein Team den Primärtumor, gestreute Tumorzellen und Metastasen. In jeder untersuchten Zelle werden alle von der Zelle aktivierten Gene analysiert. Diese Daten werden dann mit dem klinischen Verlauf der Patientinnen korreliert. Eine riesige Datenmenge, die das Bioinformatik-Team der Forschungsgruppe strukturiert. "Wir suchen in den Tumorzellen nach Markern, die mit einer schlechten Prognose für die Patientin assoziiert sind", erklärt Klein. Ende des Jahres werden die gesamten Ergebnisse der Studie vorliegen. Und einen Hinweis darauf geben, was eine Zelle zur Killerin macht.
Quelle: Fraunhofer-Institut für Toxikologie und Experimentelle Medizin ITEM
03.06.2020