Quelle: Leibniz-Forschungsinstitut für Molekulare Pharmakologie
News • Transport von Botenstoff
Ionenkanal VRAC verstärkt Immunantwort gegen Viren
VRAC/LRRC8 Chlorid-Kanäle spielen nicht nur beim Transport von Zytostatika, Aminosäuren und Neurotransmitter eine entscheidende Rolle. Sie können auch den wichtigen Botenstoff cGAMP von Zelle zu Zelle transportieren und damit eine Immunantwort bei Infektionen mit DNA-Viren verstärken.
Das hat jetzt der LRRC8/VRAC-Entdecker Prof. Thomas Jentsch vom Leibniz-Forschungsinstitut für Molekulare Pharmakologie (FMP) und vom Max-Delbrück-Zentrum für Molekulare Medizin (MDC) zusammen mit Kollegen um Prof. Hui Xiao aus Shanghai gezeigt. Da cGAMP immer dann gebildet wird, wenn sich fremde DNA im Zellinneren außerhalb des Zellkerns befindet, hat der Fund potenziell auch für andere Pathologien wie Krebs große Bedeutung.
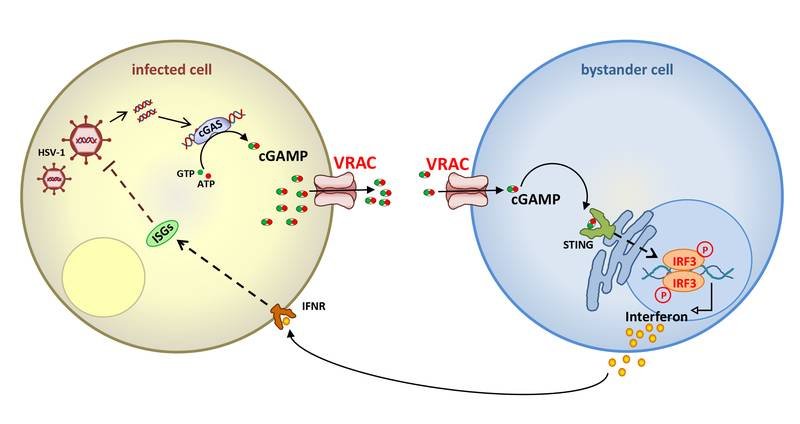
Wenn DNA-Viren wie Herpes simplex – das Coronavirus gehört als RNA-Virus nicht in diese Gruppe! - menschliche Zellen infizieren, dann geschieht das nicht ganz unbemerkt. Im Zellinneren, dem sogenannten Zytoplasma, wo DNA nichts zu suchen hat, werden Botenstoffe gebildet und beginnen Alarm zu schlagen. Die fremde DNA bindet an das Enzym cGAS, das den ‘second messenger‘ cGAMP synthetisiert. Durch Bindung an einen Rezeptor namens STING aktiviert cGAMP eine zelluläre Signalkaskade, die die Produktion von Interferonen und anderen Faktoren des angeborenen Immunsystems anschmeißt. Dieser Mechanismus wurde auch schon in Tumorzellen, die ebenfalls DNA-Fragmente im Zytoplasma freisetzen, und bei einigen bakteriellen Infektionen beobachtet.
cGAMP ist ein hochaktueller Botenstoff
Die Forschung zu cGAMP ist in den letzten Jahren regelrecht explodiert, unter anderem deshalb, weil cGAMP nicht nur in der Zelle wirkt, wo er gebildet wird, sondern auch auf andere Zellen übergeht. Unklar blieb allerdings, auf welchen Wegen das passiert. In direkt benachbarten Zellen kann cGAMP durch zellverbindende Kanäle, sogenannte „gap junctions“, gelangen. Aber wie sieht es mit den Zellen aus, die sich nicht in unmittelbarer Nachbarschaft befinden?
Forscher um Prof. Hui Xiao vom Institut Pasteur Shanghai hatten vermutet, dass weitere Transportwege eine Rolle spielen müssen, und sind dabei auf den Volumen-regulierten Anionen-Kanal VRAC gestoßen – jenen Ionenkanal, der 2014 von Prof. Thomas Jentsch und parallel von Prof. Zhaozhu Qiu (jetzt Johns Hopkins University), der ebenfalls Autor der Publikation in Immunity ist, entdeckt wurde. Gemeinsam konnte das deutsch-chinesische Forscherteam mit unterschiedlichsten Methoden zeigen: VRAC transportiert cGAMP sowohl aus der produzierenden Zelle heraus, als auch in die Empfängerzelle hinein. Dies ruft dann auch in eigentlich unbeteiligten Zellen Interferone auf den Plan und verstärkt somit die Immunantwort.
„Wir wissen jetzt, dass VRAC definitiv diesen Botenstoff transportiert“, erläutert Thomas Jentsch den bedeutsamen Fund für die Wissenschaft. „Diese Funktion kannten wir noch nicht, passt aber gut mit dem zusammen, was wir schon früher über VRAC rausgefunden haben, nämlich dass er nicht nur Chlorid, sondern zum Beispiel auch Neurotransmitter, Aminosäuren und Zytostatika transportiert, also kleine organische Moleküle. Die jetzt beobachtete Abhängigkeit des cGAMP Transports von der Untereinheit LRRC8E – VRAC ist immer aus mehreren Untereinheiten zusammengesetzt – stimmt gut mit unseren früheren Resultaten überein, die zeigten, dass diese Untereinheit den Transport von ebenfalls negativ geladenem Glutamat unterstützt.“
Die Aufnahme des Botenstoffs mittels VRAC wurde durch verschiedene Zellkultur-Experimente als auch über elektrophysiologische Untersuchen verifiziert. In einem Experiment wurden zum Beispiel Zellen mit einem DNA-Virus infiziert und diese über einen Filter von gesunden Zellen getrennt. Die Infektion konnte dadurch nicht überspringen – wohl aber zeigte sich auch in den nicht-infizierten Zellen eine Interferonantwort.
Den letzten schlagkräftigen Beweis brachten schließlich Experimente mit in Berlin generierten Knock-out-Mäusen, denen die VRAC-Untereinheit LRRC8E fehlte: Wurden die Nager mit Herpesviren infiziert, war eine viel größere Viruslast und eine geringere Interferonausschüttung nachweisbar als in nicht modifizierten Kontrollen. „Das war genau das, was wir erwartet hatten, denn die Botenstoffe konnten ja wegen des fehlenden Transportkanals nicht mehr von einer infizierten Zelle auf andere übertragen werden und dort die Immunantwort verstärken“, erklärt Professor Jentsch. „Dadurch wurde die Abwehr des Virus stark eingeschränkt."
Neue Strategien gegen DNA-Viren und Krebs
Dass VRAC, neben vielen anderen lebenswichtigen Funktionen, nun nachgewiesenermaßen auch eine Schlüsselfunktion bei Infektionen mit DNA-Viren besitzt, wird dem winzigen Ionenkanal künftig noch mehr Aufmerksamkeit verschaffen. Außerdem nehmen die Forscher an, dass VRAC eine ähnliche Rolle bei Krebs spielt. In der Tat wurde vor kurzem von anderen in Tierversuchen gezeigt, dass cGAMP-Transport aus Krebszellen in benachbarte Wirtszellen die Immunantwort gegen Tumoren verstärkt – wie cGAMP transportiert wird, blieb aber unklar.
Neben VRAC und ‚gap junctions‘ transportiert, wie letztes Jahr gezeigt, auch ein Folat-Transporter cGAMP über die Membran. VRAC kommt jedoch in mehr Zellen vor und spielt daher wahrscheinlich eine größere Rolle. Künftig könnte man etwa versuchen, VRAC zur Verstärkung der Immunantwort zu aktivieren. Ansätze dazu sind bereits in der neuen Arbeit beschrieben. „Das ganze Gebiet ist momentan ungeheuer heiß“, meint Thomas Jentsch, „und unsere Entdeckung bietet sowohl für die Infektionsforschung als auch die Krebsforschung völlig neue Perspektiven.“
Quelle: Leibniz-Forschungsinstitut für Molekulare Pharmakologie
14.04.2020