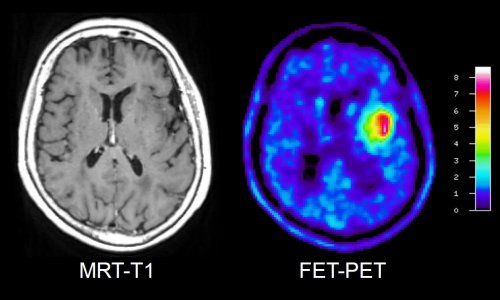
Heteronukleare MRT
Zelluläre Prozesse sichtbar machen
Einen Kernspin trägt nicht nur der Wasserstoff, sondern auch andere Atomkerne. Von besonderem Interesse ist hierbei der 23Na- Atomkern, da mithilfe der 23Na-MRT eine Beurteilung der Vitalität von Gewebe möglich ist.
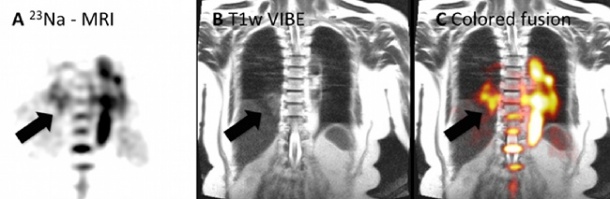

In der Membran jeder menschlichen Zelle befinden sich Ionenkanäle, durch die Natriumionen nach außen und Kaliumionen nach innen transportiert werden. 30 bis 70 Prozent des gesamten ATP-Energiestoffwechsels einer Zelle werden für die sogenannte Natrium-Kalium- Pumpe aufgewendet. „Die Natur steckt unglaublich viel Energie in die Aufrechterhaltung dieses Ionengradienten und des dadurch entstehenden elektrischen Potenzials“, betont Prof. Dr. Lothar R. Schad, Inhaber des Lehrstuhls für Computerunterstützte Klinische Medizin an der Medizinischen Fakultät Mannheim der Universität Heidelberg, „da die Natur grundsätzlich nicht verschwenderisch mit Energie umgeht, muss das ein ganz lebenswichtiger Prozess sein.“
Dieser essenzielle Prozess lässt sich mittels heteronuklearer Magnetresonanztomographie (MRT) abbilden. Normalerweise wird bei der MRT das mit dem Spin verbundene magnetische Moment der Atomkerne des Wasserstoffs gemessen. Da der Kern des Wasserstoffatoms aus nur einem Proton besteht, spricht man normalerweise von protonen- beziehungsweise mononuklearer Bildgebung. Es ist freilich auch möglich, das magnetische Moment anderer Atomkerne, die aus mehr als nur einem Proton bestehen, zu messen – allerdings funktioniert das nur bei Elementen, die einen Kernspin tragen (in der Regel bei ungeradzahligem Atomkern). Zu diesen sogenannten X-Kernen zählen die Elemente 19F, 23Na, 31P, 37Cl oder 39K – aufgrund der er-forderlichen hohen Konzentration ist jedoch nur 23Na für die MR-Bildgebung von Belang. Fluor kommt im menschlichen Körper so gut wie gar nicht vor und die anderen Kerne geben nur ein äußerst schwaches Signal. Bei 23Na ist das Signal um einen Faktor 10.000 geringer als beim Wasserstoff, bei 37Cl bereits um einen Faktor 100.000 und bei 39K um einen Faktor 1 Million.
„23Na-MRT ist ein hervorragendes Verfahren, um auf nichtinvasivem Weg in vivo die Vitalität von Gewebe zu messen“, erklärt Schad. Denn solange die Natrium-Kalium- Pumpe funktioniert, lebt die Zelle. Sobald die Energieversorgung der Zelle unterbrochen ist und somit der Ionengradient nicht mehr aufrechterhalten werden kann, stirbt sie. Innerhalb lebendiger Körperzellen ist die Natriumkonzentration zehnmal geringer als außerhalb der Zelle (5 mM gegenüber 50 mM). Lebendes Gewebe aus Zellen mit funktionierender Natrium-Kalium-Pumpe weist eine Gesamtnatriumkonzentration von circa 40 mMauf, in abgestorbenem Gewebe hingegen, wo keine Zellmembranen mehr aktiv sind und die Konzentrationsdifferenz verloren gegangen ist, steigt die Natriumkonzentration auf circa 140 mM, was sich auf den Bildern als deutlicher Signalanstieg bemerkbar macht.
Derzeit wird 23Na-MRT bei Schlaganfallpatienten, aber auch bei Gehirntumoren in der Therapieverlaufskontrolle eingesetzt. „Wir gehen schön langsam vom Kopf in den Körperstammbereich“, berichtet Schad. Abdomen, Leber, Niere, Prostata und Lunge lassen sich bereits mit heteronuklearer MRT untersuchen. „Wir hoffen, dieses Verfahren in Zukunft auch beim Herz einsetzen zu können, um nach einem Herzinfarkt zu eruieren, ob das Herzmuskelge-webe noch vital ist“, meint der Heidelberger Physiker, der in den nächsten Jahren einige interessante Studien zu diesem Thema erwartet.
Technisch gesehen ist die X-Kern-Bildgebung keine Hexerei. Jedes 3-Tesla-MRT-Gerät lässt sich heutzutage mit entsprechenden Spulen, die Na-Signale empfangen können, aufrüsten. „Damit bekommt man schon mit einem ganz konventionellen klinischen 3-Tesla- Scanner wirklich sehr gute Bilder“, bekräftigt Schad. Diese sehen so aus wie bei der ganz normalen T2-gewichteten MRT, allerdings mit schlechterer Auflösung, weil das Signal- Rausch-Verhältnis deutlich ungünstiger ist. „Die Bilder sind gröber, aber das stört nicht, weil der Signalinhalt das Spannende ist“, erläutert der Professor, „wir sehen einen zellulären Prozess, den wir beim Wasserstoff nicht so leicht sehen können. Da ist die Bildqualität in meinen Augen eher zweitrangig.“
IM PROFIL
Prof. Dr. rer. nat. Lothar R. Schad ist Inhaber des Lehrstuhls für Computerunterstützte Klinische Medizin an der Medizinischen Fakultät Mannheim der Universität Heidelberg. Er studierte Physik an der Universität Heidelberg, wo er sich auch 1991 habilitierte. Von 1997 bis 2007 war er Leiter der Gruppe „Funktionale und physiologische MRT“ am Deutschen Krebsforschungszentrum (Abteilung „Medizinische Physik in der Radiologie“) in Heidelberg, 2007 wurde er auf seinen jetzigen Lehrstuhl berufen. Schad ist Chefredakteur der „Zeitschrift für Medizinische Physik“. Seine Forschungsschwerpunkte liegen auf bildgebenden Verfahren in der onkologischen Therapieplanung und -verlaufskontrolle sowie auf der Entwicklung neuer MR-Techniken unter anderem auf den Gebieten 23Na-Bildgebung, diffusionsgewichtete Magnetresonanztomographie (DW-MRT), Diffusions-Tensor- Bildgebung (DT-MRT) und BOLD-MRT.
30.05.2013