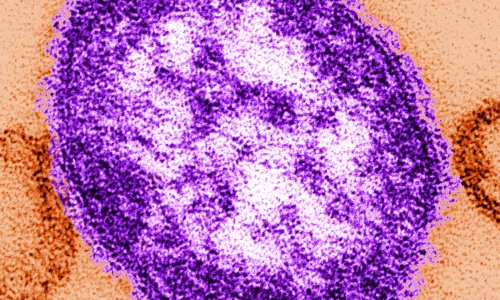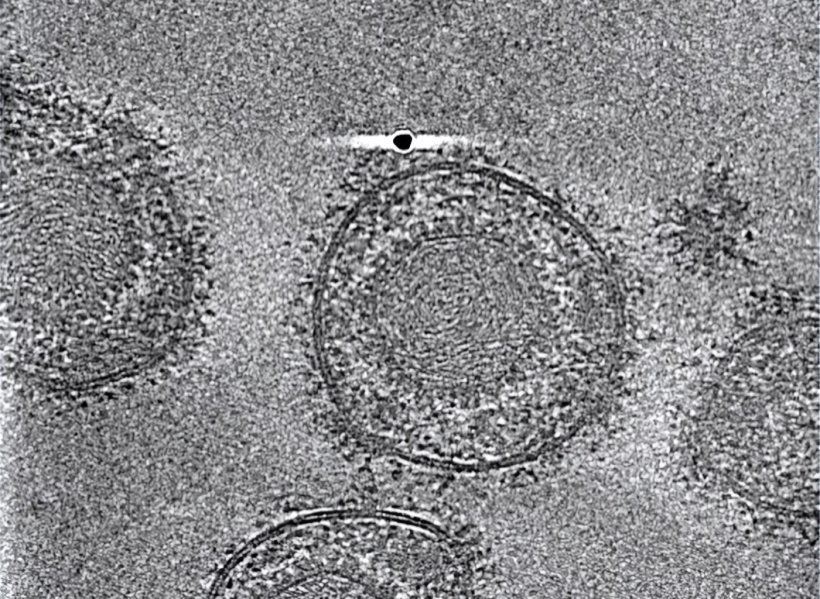
© Benjamin Vollmer / Centre for Structural Systems Biology
News • HSV-1-Schutz für gefährdete Gruppen
Herpes: Alpaka-Nanoteilchen sollen Infektionen verhindern
Forschenden in Hamburg und Göttingen ist es gelungen, einen Mini-Antikörper zu finden, mit dem ein Protein ausgeschaltet werden kann, das für die Infektion essenziell ist
Brennen, Bläschen, Schmerzen: Weltweit infizieren sich jährlich mehr als 40 Millionen Menschen mit dem Herpesvirus. Für Neugeborene und Menschen mit geschwächtem Immunsystem kann das Virus eine ernste Bedrohung darstellen. Forschenden in Hamburg und Göttingen ist es nun gelungen, einen Mini-Antikörper zu finden, mit dem ein Protein ausgeschaltet werden kann, das für die Infektion essenziell ist. Die jetzt im Fachjournal Nature veröffentlichten Erkenntnisse eröffnen mittelfristig neue Möglichkeiten, um schwere Herpesinfektionen zu behandeln und ihnen vorzubeugen.
Es kommt, um zu bleiben: Einmal infiziert, verbleibt das Herpesvirus ein Leben lang im Körper. Betroffene sind latent infiziert. Es verbirgt sich in Nervenzellen vor dem Immunsystem und wartet, weitgehend inaktiv, auf den passenden Zeitpunkt. Bei „günstiger“ Gelegenheit – beispielsweise bei einem geschwächten Immunsystem oder Stress – vermehrt sich das Virus wieder, nicht zuletzt, um neue „Wirte” anzustecken. Etwa 60% der Menschheit trägt das Herpes-Simplex-Virus Typ 1 (HSV-1) in sich, das gewöhnlich Hautläsionen auslöst und auch als Lippenherpes bekannt ist. Knapp 20% der Bevölkerung leiden an Genitalherpes, primär verursacht durch den verwandten, sexuell übertragbaren HSV-2 oder auch durch HSV-1.
© Benjamin Vollmer / Centre for Structural Systems Biology
Was für ansonsten gesunde Betroffene vor allem schmerzhaft und unangenehm ist, kann für Menschen mit Vorerkrankungen drastische, teils tödliche, Folgen haben. Schwere Verläufe betreffen das zentrale Nervensystem. Besonders gefährdet sind Neugeborene: Liegt bei der Mutter eine aktive Herpesinfektion vor, kann sich das Kind während der Geburt leicht anstecken. Dieser sogenannte neonatale Herpes geht oft mit bleibenden neurologischen Schäden einher und kann für das Kind sogar tödlich enden.
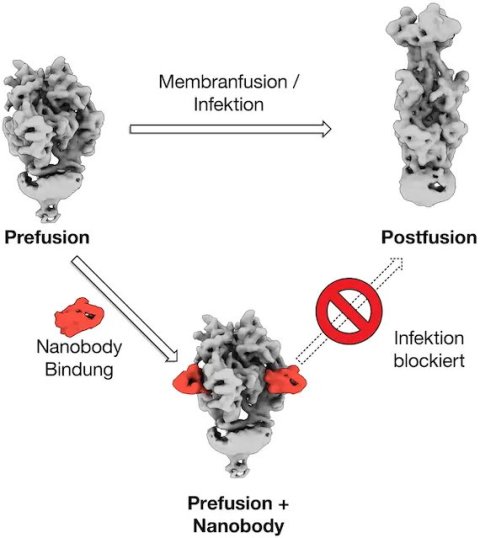
Um eine Wirtszelle zu infizieren, dockt das Herpesvirus zunächst an deren äußerer Zellmembran an. Im nächsten Schritt fusioniert es seine Membranhülle mit der der Wirtszelle. Anschließend schleust es sein Erbgut in die angegriffene Zelle ein, um neue Viren zu produzieren. Eine Schlüsselrolle bei der Fusion spielt das Glykoprotein B (gB). Es ist „energiegeladen“ und nutzt diese Energie, um die Virushülle mit der Zellmembran zu verschmelzen. Bei diesem Fusionsprozess verändert gB seine dreidimensionale Form. Das macht es zu einem attraktiven Angriffspunkt für Medikamente, doch existieren bisher keine antiviralen Wirkstoffe, die auf gB abzielen; kritische Regionen des Proteins sind unzugänglich oder geschützt.
Forschende des Leibniz-Instituts für Virologie (LIV), der Universität Hamburg (UHH), und des Universitätsklinikums Hamburg-Eppendorf (UKE) am Centre for Structural Systems Biology (CSSB) in Hamburg sowie des Göttinger Max-Planck-Instituts (MPI) für Multidisziplinäre Naturwissenschaften ist es gelungen, den gB-Komplex in seiner bisher nicht zugänglichen fusionsbereiten Form zu stabilisieren. Sie konnten dessen hochaufgelöste Struktur mittels Kryo-Elektronenmikroskopie, Bildanalyse und Struktur-Modellierung bestimmen. Dabei waren die Technologieplattformen für ausgebaute Lichtmikroskopie und Kryo-Elektronenmikroskopie (Kryo-EM) am CSSB essenziell.
Die Nanobodies können nicht nur bei einer bestehenden Herpesinfektion ergänzend zu den gängigen Medikamenten eingesetzt werden. Sie könnten zukünftig besonders gefährdete Personen vor einer Herpesinfektion oder dem erneuten Ausbrechen einer latenten Infektion schützen
Benjamin Vollmer
Das Göttinger Team isolierte aus geimpften Alpakas einen Mini-Antikörper, einen sogenannten Nanobody, der gB in bereits sehr geringen Konzentrationen neutralisiert. Der Nanobody bindet die fusionsbereite Form von gB und verhindert, dass es die Bewegungen ausführen und die Energie freisetzen kann, die für die Fusion erforderlich ist.
Alpakas, Lamas oder anderen Kamele besitzen Antikörper, die einfacher aufgebaut als normale Säugetier-Antikörper. Diese lassen sich im Labor zu sogenannten Nanobodies noch weiter verkleinern. Forschende in der Gruppe von Kay Grünewald, Leiter der Abteilung Strukturelle Zellbiologie der Viren am LIV, UHH und CSSB in Hamburg produzierten eine gB-Zubereitung, mit dem das Team in Göttingen ein Alpaka immunisierte, und die Produktion von Antikörpern auslöste. „Dabei war die Belastung für unser Alpaka Max sehr gering, vergleichbar mit einer Impfung und Blutuntersuchung beim Menschen“, erklärt Dirk Görlich, Direktor am MPI und Leiter der Abteilung Zelluläre Logistik. Nach einer Blutspende war Max‘ Einsatz beendet. Die weitere Arbeit erfolgte im Labor mithilfe von Hightech-Geräten, Enzymen, Bakterien, Bakteriophagen und Computern. Schlussendlich werden Nanobodies mikrobiologisch – also ähnlich wie Bier – produziert.
Aus der Blutprobe gewannen die Forschenden zunächst die Baupläne für rund eine Milliarde verschiedener Nanobodies. Von diesen ist jedoch nur ein verschwindend kleiner Anteil gegen das eigentliche Ziel gerichtet. gB-spezifische Nanobodies haben die Göttinger mithilfe von Bakteriophagen isoliert und dann einzelne Vertreter mikrobiologisch produziert. Diese wurden dann in Hamburg auf ihre anti-virale Wirkung getestet. „Wir konnten dabei genau einen Nanobody identifizieren, der eine starke neutralisierende Wirkung hat. Spannend ist, dass er sowohl gegen HSV‑1 als auch HSV-2 wirkt“, berichtet Görlich.
In Hamburg gelang es dem Team, die 3D-Struktur des nativen HSV-2 gB mit dem gebundenen Nanobody aufzuklären. Dieses Model und weitere hochaufgelöste Kryo-EM-Modelle von gB vor und nach der Fusion – erstellt mit Hilfe des Teams von Maya Topf, Leiterin der Abteilung Integrative Virologie am LIV, UKE und CSSB, die fortgeschrittene computerbasierte Werkzeuge für die Modellierung und Validierung einsetzte – lieferten Einblicke in kritische Positionen in gB und entschlüsselten so den Neutralisierungsmechanismus. „Unsere Ergebnisse legen nahe, dass die Bindung des Nanobodies das Protein daran hindert, seine Form so zu verändern, dass es die Membranen fusionieren kann. So wird die Infektion verhindert“, sagt Grünewald.
Die Entdeckungen der Teams versprechen einen neuen Ansatz, um Herpesinfektionen zu behandeln und ihnen vorzubeugen. „Die Nanobodies können nicht nur bei einer bestehenden Herpesinfektion ergänzend zu den gängigen Medikamenten eingesetzt werden. Sie könnten zukünftig besonders gefährdete Personen vor einer Herpesinfektion oder dem erneuten Ausbrechen einer latenten Infektion schützen“, sagt Benjamin Vollmer, leitender Wissenschaftler des Projekts in Grünewalds Gruppe und Erstautor der Studie. „Dazu ist es zwar noch ein längerer Weg, aber Menschen, deren Immunsystem besonders schwach ist, werden umso mehr von den innovativen Antikörpern profitieren können. Dazu zählen beispielsweise Neugeborene, HIV-Infizierte und Menschen mit Krebs, Autoimmunerkrankungen oder einer bevorstehenden Organtransplantation.“ Leidet eine Schwangere an einer aktiven Herpesinfektion, könnte eine prophylaktische Gabe von Nanobodies an die werdende Mutter verhindern, dass sich das Neugeborene ansteckt. Der Patentantrag, um die Nanobodies für die klinische Anwendung weiterzuentwickeln und Partner aus der Industrie zu gewinnen, ist bereits gestellt.
Quelle: Max-Planck-Institut für Multidisziplinäre Naturwissenschaften
04.09.2025