Bild: Universität Basel, Biozentrum
News • Problematische Proteine
Die "Leibgarde" der Parkinson-Krankheit
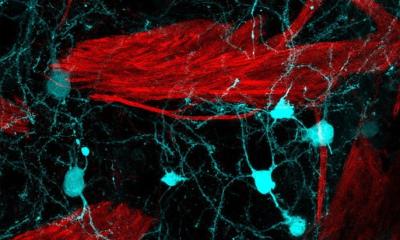
Helferproteine in menschlichen Zellen gehen eine dynamische Verbindung mit dem Parkinson-Protein α-Synuclein ein. Wird die Beziehung zu diesen "Leibwächtern" gestört, kommt es zu Zellschäden und zur Entstehung der für Parkinson typischen Lewy-Körperchen.
Dies berichtet ein Forschungsteam am Biozentrum der Universität Basel in "Nature". Die Parkinson-Krankheit gehört zu den häufigsten neurodegenerativen Erkrankungen. In der Schweiz leben etwa 15.000 Betroffene. Aufgrund der weltweit steigenden Lebenserwartung, rechnen viele Experten mit einem rasanten Anstieg von Parkinson-Fällen. Die Ursachen von Parkinson, bei dem es zu einem fortschreitenden Absterben von Nervenzellen im Gehirn kommt, sind bis heute nicht genau bekannt. Daher ist die Entwicklung wirkungsvoller Therapien umso schwieriger.
Einig ist man sich darüber, dass das Protein α-Synuclein eine Rolle bei der Entstehung von Parkinson spielt. Forschende um den Strukturbiologen Prof. Sebastian Hiller haben nun herausgefunden, dass Helferproteine, sogenannte Chaperone, wie persönliche Leibwächter dieses Protein in menschlichen Zellen ständig bewachen. Können die Chaperone ihr Aufgabe nicht wahrnehmen, zeigt α-Synuclein seine negativen Seiten und verursacht gravierende Schäden in der Zelle.
Dieser Artikel könnte Sie auch interessieren
News • Wichtiges Protein
Wie Chaperone die Krebsabwehr in Gang halten
Über Leben und Tod einer Zelle entscheidet das Anti-Tumor-Protein p53: Erkennt es Schäden im Erbgut, treibt es die Zelle in den Selbstmord. Eine neue Forschungsarbeit an der Technischen Universität München (TUM) zeigt, dass diese körpereigene Krebsabwehr nur funktioniert, wenn bestimmte Proteine, die Chaperone, dies zulassen.
In menschlichen Zellen gibt es etwa dreißig bis vierzig solcher Chaperone, die potenziell mit α-Synuclein interagieren können. Die Wissenschaftler haben systematisch auf atomarer Ebene untersucht, an welcher Stelle die molekularen Leibwächter mit dem α-Synuclein wechselwirken. "Wir haben mithilfe hochmoderner NMR-Spektrometer ein spezifisches Muster entdeckt, das uns zeigt, wo genau die Chaperone mit α-Synuclein in Kontakt treten", erklärt Hiller. "Dabei handelt es sich nicht um eine feste, starre Verbindung, sondern um dynamische, ständig wechselnde Beziehungen." In gesunden Zellen wird das Parkinson-Protein stets von Chaperonen begleitet. So bleibt es transportfähig und zudem besteht ein Pool, der den Bedarf an funktionstüchtigen α-Synuclein-Proteinen deckt.
Mit unserer Arbeit rütteln wir an dem Paradigma, dass Chaperone nur dazu da sind, um anderen Proteinen dabei zu helfen, ihre richtige Form zu finden
Sebastian Hiller
Schwerwiegende Folgen hat es, wenn die Chaperone ihrer Leibwächter-Funktion nicht mehr nachkommen können. Chemische Veränderungen am α-Synuclein beispielsweise, wie sie auch bei Parkinson zu beobachten sind, stören die Interaktion mit den Chaperonen. Dies führt dazu, dass sich "unbegleitete" α-Synuclein-Proteine an der Membran von Mitochondrien, den Zellkraftwerken, ansammeln und diese nach und nach zerstören. Wie erst kürzlich gezeigt wurde, bestehen die für Parkinson typischen Lewy-Körperchen zu großen Teilen aus solchen Membrantrümmern von Mitochondrien und α-Synuclein. "Mit unserer Arbeit rütteln wir an dem Paradigma, dass Chaperone nur dazu da sind, um anderen Proteinen dabei zu helfen, ihre richtige Form zu finden", so Hiller. "Chaperone sind aber weit mehr als Faltungshelfer. Sie kontrollieren zelluläre Prozesse, indem sie mit einer Vielzahl von Proteinen flexible Beziehungen eingehen und sie wie ein Schatten begleiten."
Das Verständnis über die molekularen Interaktionen sowie das Verhältnis der beteiligten Partner liefert wichtige Impulse zur Behandlung von Parkinson. Zukünftig sollten auch die Chaperone sowie die Aufrechterhaltung ihrer Funktionsfähigkeit bei der Entwicklung von Therapien in Betracht gezogen werden.
Quelle: Universität Basel
08.12.2019