© peterschreiber.media – stock.adobe.com
News • Forschung zu zellulären Abläufen
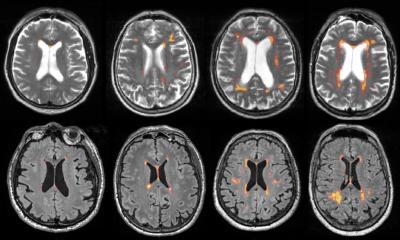
Ischämischer Schlaganfall: Was passiert im Gehirn?
DFG-Projekt untersucht zelluläre Mechanismen nach ischämischem Schlaganfall
Bei einem ischämischen Schlaganfall wird die Blutzufuhr zum Gehirn unterbrochen. Das löst eine gefährliche Kettenreaktion aus: Blutgefäße im Gehirn verändern sich, Entzündungsprozesse laufen ab und das Zusammenspiel von Nervenzellen, Blutgefäßen und den sie unterstützenden Zellen im Gehirn, also die neurovaskuläre Einheit, ist gestört. Dadurch sterben Nervenzellen nach und nach ab. Wie genau diese Abläufe zusammenhängen, ist trotz intensiver Forschung bisher unklar. Ein neues Projekt an der Universität Augsburg untersucht diese Prozesse unter dem Titel „Ischämie-bedingte Beeinträchtigungen der neurovaskulären Einheit“. Es wird bis Anfang 2029 von der Deutschen Forschungsgemeinschaft (DFG) gefördert.

Bildquelle: Universität Augsburg; Foto: Kennet Rouna
Die Forschung des Teams um Prof. Dr. Anja Meissner, Professorin für Physiologie & Vaskuläre Biologie am Institut für Theoretische Medizin, könnte helfen, neue Therapieansätze zu entwickeln. Denn bisher beschränkt sich die Behandlung eines ischämischen Schlaganfalls aufgrund vieler unbekannter Faktoren vor allem darauf, die Durchblutung der geschädigten Hirnregion wiederherzustellen. Doch wenn die Veränderungen im Gehirn einmal besser verstanden sind, eröffnet das neue Behandlungsmöglichkeiten, hoffen die Forschenden.
Im Fokus des Projekts steht das Molekül Sphingosin-1-phosphat (S1P) und insbesondere dessen Rezeptor S1PR3. Das Molekül S1P ist wichtig für die Gesundheit der Blutgefäße und für die Immunantwort des Körpers. Es kann an bestimmte Strukturen auf Zellen, sogenannte S1P-Rezeptoren, binden. Diese können sich positiv auf die Blutzirkulation im Gehirn auswirken. Einer der Rezeptoren, genannt S1PR3, ist nach einem Schlaganfall stark aktiviert, zeigen bisherige Untersuchungen von Meissner und ihrem Team.
Wie genau diese Aktivierung die Schädigung im Gehirn beeinflusst, ist bislang jedoch unklar. „Wirkt sie sich eher schützend oder schädlich aus? Kann dieser Signalweg therapeutisch beeinflusst werden? Das wollen wir herausfinden“, sagt Meissner. „Dafür untersuchen wir, wie und wann genau S1PR3 in verschiedenen Zelltypen aktiv wird.“
Dieser Artikel könnte Sie auch interessieren

News • Themenkanal
Schlaganfall im Fokus
Schlaganfälle sind die zweithäufigste Todesursache weltweit und eine der häufigsten Ursachen für Behinderungen. Aufgrund der immer besseren Versorgung sinkt die Sterblichkeit in Deutschland zwar. Dennoch rechnen Experten angesichts der älter werdenden Bevölkerung mit steigenden absoluten Erkrankungszahlen. Lesen Sie hier mehr zu aktueller Forschung und Behandlungsmöglichkeiten.
Der Rezeptor S1PR3 befindet sich vor allem in Astrozyten – Zellen, die für die Funktionsfähigkeit der neurovaskulären Einheit entscheidend sind, da sie beispielsweise Blutgefäße und Nervenzellen funktionell miteinander verknüpfen. S1PR3 findet sich jedoch auch in Zellen der Blutgefäße und wird dort ebenfalls stark aktiviert.
Die Aktivierung des Rezeptors S1PR3 könnte eventuell auch als diagnostischer Marker genutzt werden
Anja Meissner
Denkbar ist, dass diese Aktivierung teils zum Krankheitsbild gehört, teils aber auch einen Schutzmechanismus darstellt. So hilft sie, eine Hülle um das abgestorbene Gewebe zu bilden. Das ist wichtig, da dieser nekrotische Kern giftig für das umgebende Gewebe ist. Allerdings kann das Narbengewebe später den Wiederaufbau neuronaler Verbindungen behindern - und somit die Genesung bremsen. „Es könnte sinnvoll sein, das Hochfahren von S1PR3 zu steuern, also in bestimmten Zeitfenstern eher zu fördern, in anderen eher zu unterdrücken“, erklärt Meissner. „Wenn wir dahinterkommen, könnte das langfristig helfen, die Gehirnschädigung nach einem Schlaganfall deutlich zu reduzieren und die Heilungschancen der Betroffenen zu verbessern.“
Um diese Mechanismen zu analysieren, setzt das Forschungsteam auf innovative Maus- und Zellkulturmodelle. Durch die Kombination beider Modelle können die komplexen Abläufe genau untersucht werden, zum einen im lebenden Organismus, zum anderen in komplexen Zellkulturmodellen, die das Verhalten verschiedener Zellen der neurovaskulären Einheit nach einem Schlaganfall nachbilden können. So kann die spezifische Kommunikation auf zellulärer Ebene untersucht werden.
Das Anwendungsgebiet der Forschung von Meissners Team umfasst neben möglichen Therapien auch die präzisere Vorhersage von Heilungsaussichten nach einem ischämischen Schlaganfall. „Die Aktivierung des Rezeptors S1PR3 könnte eventuell auch als diagnostischer Marker genutzt werden“, erklärt Meissner. Bis dahin ist noch ein langer Weg. Doch Meissner ist zuversichtlich: „Als Forschende hoffen wir, dass die Erkenntnisse aus unserer Grundlagenforschung eines Tages in die Klinik übertragen werden können – und in der Zukunft einmal den Patienten zugutekommen.“
Quelle: Universität Augsburg
30.05.2025