News • Survivin-Forschung
Das „Überlebensprotein“ für Krebszellen ausschalten
Man nennt es das „Überlebensprotein“, weil es eine zentrale Rolle beim Wachstum von Krebszellen spielt: Survivin beeinflusst gleich zwei wichtige Prozesse in Körperzellen – den Zelltod sowie die Zellteilung.
Einem Team aus der Chemie und Biologie der Universität Duisburg-Essen (UDE) ist es nun gelungen, ein passgenaues Molekül zu entwickeln, welches das Eiweißmolekül an einer definierten Stelle binden und ausschalten kann. Die Fachzeitschrift "Nature Communications" berichtet.
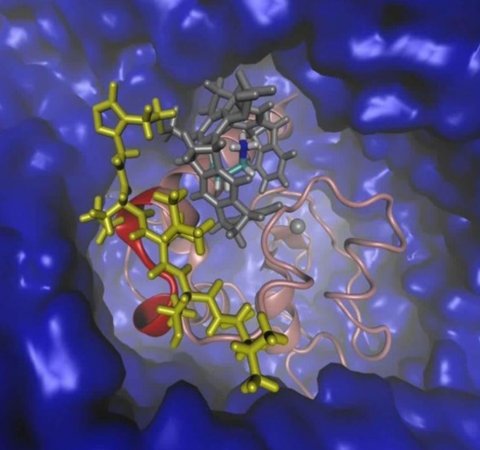
© UDE/Sanchez-Garcia
Proteine, umgangssprachlich auch Eiweiße genannt, steuern nahezu alle lebenswichtigen Vorgänge in unseren Körperzellen. Wenn sie nicht korrekt funktionieren, zu viel oder zu wenig vorhanden sind, kann dies zu krankhaften Prozessen führen. Ein Beispiel sind Krebserkrankungen, bei denen oft fehlerhaft aktivierte Proteine eine Rolle spielen. Diese Proteine sind deshalb wichtige Ziele für die Wirkstoffsuche in der biomedizinischen Forschung.
Jedoch gibt es eine Vielzahl von Proteinen, die einfach keine passenden Angriffspunkte bieten, um einen herkömmlichen Wirkstoff andocken zu lassen. Deshalb entwickeln Wissenschaftler des UDE-Sonderforschungsbereichs 1093 kleine, außergewöhnliche Moleküle, sogenannte supramolekulare Liganden, die passgenau an deren Oberfläche binden können.
Nun ist es dem Wissenschaftlerteam um Prof. Shirley Knauer, Prof. Elsa-Sanchez-Garcia und Prof. Thomas Schrader gelungen, mit solchen maßgeschneiderten Molekülen auf eine kritische Schnittstelle zu zielen, die für das Überleben von Krebszellen wichtig ist. „Das Protein Survivin kommt eigentlich im gesunden, erwachsenen Organismus kaum vor“, so Knauer. „Bei Krebszellen wird dessen Produktion jedoch hochgefahren.“ Mit einem maßgeschneiderten künstlichen Liganden konnten die Wissenschaftler genau die Stelle des Survivins blockieren, die für seine Aktivierung und den Transport aus dem Zellkern verantwortlich ist und das Protein somit „ausschalten“.
Jedes Protein hat eine einzigartige, bewegliche, dreidimensionale Struktur mit einer zerklüfteten Oberfläche, die Schleifen und Nischen ausbilden kann. Das Team um Sanchez-Garcia fand durch rechnergestützte Analysen der Protein-Oberfläche heraus, dass sich die wichtige Schnittstelle auf einer geordneten, aber etwas dynamischen Schleife befindet. Mit diesen Informationen und ergänzenden Strukturanalysen konnten die Chemiker um Schrader den Liganden für diese besonders schwierige Oberfläche entwickeln.
Quelle: Universität Duisburg-Essen
09.03.2021