News • Krebsforschung
CAR-T-Zelltherapie: Eine wirksame Waffe gegen Lymphome
Forschende am Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC) haben eine neue Variante der CAR-T-Zell-Therapie entwickelt.
Im Fachblatt „Nature Communications“ zeigt das Team, dass sich das Verfahren vor allem bei follikulären Lymphomen und chronisch-lymphatischer Leukämie, der häufigsten Form von Blutkrebs, als sehr effektiv erweist.
In Krebszellen sieht die Körperabwehr für gewöhnlich keine Gefahr. Um diesen mitunter tödlichen Irrtum zu korrigieren, verfolgen Forschende eine raffinierte Idee: Man entnehme Krebspatienten ein paar Immunzellen und rüste sie im Labor derart auf, dass sie bestimmte Oberflächeneiweiße der entarteten Zellen erkennen. Anschließend vermehrt man die Immunzellen und injiziert sie zurück ins Blut – auf dass sie sich im Körper auf die Reise begeben, alle Krebszellen aufspüren und zielgerichtet attackieren. Tatsächlich gibt es bereits erste zugelassene Behandlungen, die auf dieser Idee basieren: Sogenannte CAR-T-Zellen kommen in Europa seit dem Jahr 2018 insbesondere bei Patienten mit B-Zell-Lymphomen zum Einsatz, denen die gängigen Krebstherapien nicht geholfen haben.
Dieser Artikel könnte Sie auch interessieren
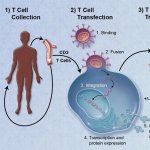
News • Krebsbehandlung
2 Jahre CAR-T-Zelltherapie: Eine Zwischenbilanz
Die CAR-T-Zell-Therapie eröffnet neue Perspektiven für eine gezielte Immuntherapie maligner Erkrankungen. Die beiden ersten kommerziell verfügbaren Präparate wurden vor zwei Jahren für Patienten mit rezidivierten/refraktären, aggressiven B-Zell-Lymphomen und rezidivierter/refraktärer B-Linien-ALL zugelassen.
T-Zellen sind die Polizeistreife des Immunsystems. Die Abkürzung CAR steht für „chimärer Antigenrezeptor“ – die Streife ist also mit einer neuen, im Labor konstruierten Spezialantenne ausgerüstet, die auf ein Oberflächeneiweiß der Krebszellen ausgerichtet ist. Dank dieser Antenne können wenige T-Zellen eine Vielzahl an Krebszellen überführen und unschädlich machen. Idealerweise patrouillieren die CAR-T-Zellen über Wochen, Monate oder gar Jahre im Körper und kontrollieren so das Tumorwachstum.
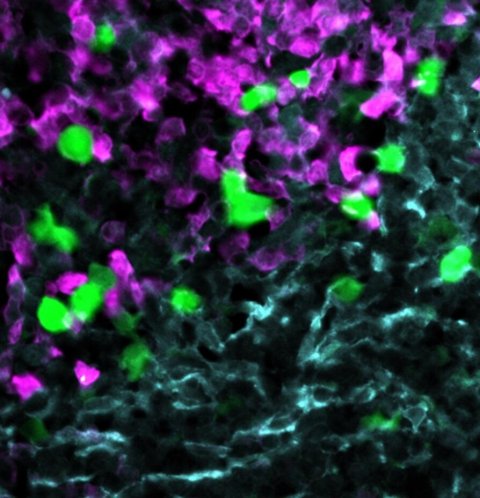
© AG Höpken / Rehm, MDC
Bislang war die Antenne der CAR-T-Zellen vorrangig gegen das Protein CD19 gerichtet, das B-Zellen – die ebenfalls zu den Immunzellen gehören – auf ihrer Oberfläche tragen. Allerdings schlägt diese Form der Therapie längst nicht bei allen Patienten an. Ein Team um Dr. Uta Höpken, die Leiterin der Arbeitsgruppe „Mikroumgebung als Regulator bei Autoimmunität und Krebs“ am MDC, hat jetzt eine Variante entwickelt, mit der die T-Zellen im Labor für ein anderes Erkennungsmerkmal sensibilisiert werden: das Oberflächeneiweiß CXCR5 der B-Zellen.
„CXCR5 wurde vor mehr als 20 Jahren am MDC erstmals beschrieben und fast ebenso lang forsche ich selbst an diesem Protein“, sagt Höpken. „Umso mehr freue ich mich, dass es uns jetzt tatsächlich gelungen ist, CXCR5 zu nutzen, um Non-Hodgkin-Lymphome wie das follikuläre und das Mantelzell-Lymphom sowie chronische Leukämien im Labor effektiv zu bekämpfen.“ Bei dem Protein handelt es sich um einen Rezeptor, mit dessen Hilfe reife B-Zellen vom Knochenmark – wo sie gebildet werden – in die Organe des Immunsystems, etwa in die Lymphknoten und die Milz, gelangen. „Ohne den Rezeptor würden die B-Zellen ihren Zielort, die B-Zell-Follikel dieser lymphatischen Organe, nicht finden“, erläutert Höpken.
„Alle reifen B-Zellen, auch die entarteten, tragen diesen Rezeptor auf ihrer Oberfläche. Deshalb schien er uns gut geeignet zu sein, um Tumore der B-Zellen aufzuspüren – so dass gegen CXCR5 gerichtete CAR-T-Zellen den Krebs attackieren können“, sagt Janina Pfeilschifter, Doktorandin in Höpkens Team. Sie und Dr. Mario Bunse aus der gleichen Arbeitsgruppe sind Erstautoren der Publikation. „In unserer Studie haben wir durch Experimente mit menschlichen Krebszellen und zwei Mausmodellen gezeigt, dass diese Immuntherapie sicher und sehr wirksam ist“, sagt Pfeilschifter.
Vor allem für Patienten mit einem follikulären Lymphom oder chronisch-lymphatischer Leukämie (CLL) könnte sich der neue Ansatz gut eignen. „An beiden Krebsarten sind neben den B-Zellen auch follikuläre T-Helferzellen beteiligt, die CXCR5 ebenfalls auf ihrer Oberfläche tragen“, erklärt Bunse. Die auf das Erkennungsmerkmal spezialisierte Antenne, den CXCR5-CAR, hat Dr. Julia Bluhm generiert – in ihrer Zeit als Doktorandin in der MDC-Arbeitsgruppe „Translationale Tumorimmunologie“, die der Mediziner Dr. Armin Rehm leitet. Er und Höpken sind die korrespondierenden Autoren der Studie.
Pfeilschifter und Bunse zeigten zunächst, dass verschiedene menschliche Zellen, etwa aus Blutgefäßen, dem Darm und dem Gehirn, den Rezeptor CXCR5 nicht auf ihrer Oberfläche tragen und daher in der Kulturschale auch nicht von den mit CXCR5-CAR ausgerüsteten T-Zellen attackiert werden. „Das ist wichtig, damit es bei einer Therapie nicht zu unerwarteten Organschäden kommt“, erläutert Pfeilschifter. Dagegen zeigten Experimente mit menschlichen Tumorzelllinien, dass entartete B-Zellen aus ganz unterschiedlichen Formen von B-Non-Hodgkin-Lymphomen den Rezeptor allesamt aufweisen.
Professor Jörg Westermann von der Medizinischen Klinik mit Schwerpunkt Hämatologie, Onkologie und Tumorimmunologie der Charité – Universitätsmedizin Berlin am Campus Virchow-Klinikum stellte dem Team darüber hinaus Tumorzellen von Patienten mit CLL oder B-Non-Hodgkin-Lymphomen zur Verfügung. „Auch dort konnten wir CXCR5 auf allen B-Lymphomzellen und follikulären T-Helferzellen nachweisen“, sagt Pfeilschifter. Brachten sie und Bunse die Tumorzellen in der Kulturschale mit den CXCR5-CAR-T-Zellen zusammen, waren nach 48 Stunden fast alle entarteten B- und T-Helferzellen aus der Gewebeprobe verschwunden.
Dieser Artikel könnte Sie auch interessieren

Artikel • DGHO-Jahrestagung 2018
Krebs: die Innovationswelle rollt
In der Hämatologie und Medizinischen Onkologie gibt es laufend Neues. Die zunehmende Stratifizierung der Krebstherapien stellt jedoch für die klinische Forschung eine große Herausforderung dar. Tumorzellen sind durch Mutationen genetisch veränderte Zellen und müssten daher eigentlich von Immunsystem erkannt und zerstört werden.
Auch an zwei Mausmodellen haben die Forscher das neue Verfahren getestet. „Krebskranke bekommen die CAR-T-Zellen ja über eine Infusion ins Blut. Wir brauchen also Tierversuche, um zu zeigen, dass die Zellen ihren Einsatzort – die Nischen, die sich der Krebs gesucht hat – finden, sich dort vermehren und erfolgreich ihren Dienst verrichten“, sagt Höpken. Bei den Modellen handelte es sich zum einen um Tiere mit einem stark unterdrückten Immunsystem, die daher mit menschlichen CAR-T-Zellen behandelt werden konnten, ohne dass es zu Abstoßungsreaktionen kam. „Zum anderen haben wir speziell für die aktuelle Studie ein reines Mausmodell für die CLL entwickelt“, berichtet Bunse. „Diesen Tieren haben wir per Infusion Mäuse-CAR-T-Zellen gegen CXCR5 verabreicht und konnten so reife B-Zellen und T-Helferzellen, auch die entarteten, aus den B-Zell-Follikeln der lymphatischen Organe eliminieren.“
Zu schweren Nebenwirkungen sei es bei den Mäusen nicht gekommen. „Aus der Erfahrung mit Krebskranken weiß man zwar, dass eine CAR-T-Zell-Therapie das Infektionsrisiko ein paar Monate lang erhöht“, sagt Rehm. Doch diese Nebenwirkung sei in der Praxis fast immer gut beherrschbar.
„So eine Publikation stemmt kein Labor allein. Sie ist nur dank einer erfolgreichen Zusammenarbeit vieler Kolleginnen und Kollegen am MDC und der Charité entstanden“, betont Höpken. Für sie ist die Studie der erste Schritt zu einem „lebenden Medikament“ - ähnlich wie andere zelluläre Immuntherapien, die am MDC entwickelt werden. „Wir kooperieren bereits mit zwei Krebsmedizinern der Charité und bereiten momentan mit ihnen gemeinsam eine klinische Phase-1/2-Studie vor“, ergänzt Höpkens Kollege Rehm. Beide hoffen, dass schon sehr bald die ersten Patienten von ihrer neuen CAR-T-Zell-Therapie profitieren.
Quelle: Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC)
12.01.2021