Neuer Wirkstoff
Aussichtsreiche Behandlungsperspektiven bei aggressivem Brustkrebs
Wissenschaftler der Universität Zürich haben erstmals aufgeklärt, warum sich viele Krebszellen bei aggressiven Formen von Brustkrebs relativ rasch an die Behandlung mit Antikörpern anpassen. Anstatt abzusterben, werden sie bloss in einen inaktiven Zustand versetzt. Die Forscher haben nun einen Wirkstoff entwickelt, der die Krebszellen sehr wirksam tötet, ohne gesunde Zellen in Mitleidenschaft zu ziehen.
Allein in der Schweiz erkranken jährlich mehr als 5.700 Frauen an Brustkrebs, und knapp 1.400 Betroffene sterben daran. In vielen sehr aggressiven Formen von Brustkrebs tragen die Zellen auf ihrer Oberfläche eine zu grosse Menge des Rezeptors HER2. Dies führt zu einem unkontrollierten Wachstum der Zellen. Verschiedene Antikörper, etwa Trastuzumab und Pertuzumab, die sich gegen den HER2-Rezeptor richten, werden seit Jahren in der Brustkrebstherapie eingesetzt. Allerdings töten diese Antikörper die Krebszellen nicht ab, sondern versetzen sie bloss in eine Art Schlafzustand, aus dem sie jederzeit wieder aufwachen können.
Weshalb Brustkrebszellen resistent gegen Antikörpertherapie werden
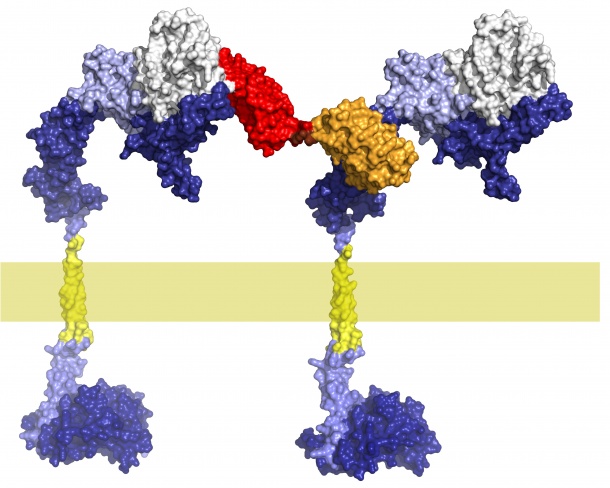
Andreas Plückthun, Direktor des Biochemischen Instituts der Universität Zürich, hat nun zusammen mit Postdoc Rastik Tamaskovic und Doktorand Martin Schwill herausgefunden, warum diese Antikörper nicht zum Absterben der Krebszellen führen, sondern bloss das Tumorwachstum verlangsamen. Der Rezeptor HER2 teilt der Zelle auf mehreren Signalübertragungswegen gleichzeitig mit, dass sie wachsen und sich teilen soll. Die bisher verfügbaren Antikörper blockieren aber nur einen dieser Übertragungswege, während die anderen aktiv bleiben. Der wichtigste dieser offenen Wege führt über die zentrale Schaltstelle namens RAS. «Dieses Eiweiss ist verantwortlich dafür, dass das vom HER2-Rezeptor ausgehende Wachstumssignal wieder aktiviert wird. Die Antikörper verlieren ihre Wirkung, und die Krebszellen wuchern weiter», erklärt Andreas Plückthun den Mechanismus, der erstmals im Detail aufgeklärt wurde.
Die UZH-Wissenschaftler haben nun eine erstaunlich wirksame Lösung gefunden, um alle Signale von HER2 in den Krebszellen gleichzeitig auszuschalten. Sie haben eine Proteinverbindung konstruiert, die gezielt an zwei HER2-Rezeptoren gleichzeitig bindet und deren räumliche Struktur verändert. Durch diese «Verbiegung» können die Rezeptoren gar keine Wachstumssignale mehr ins Zellinnere weiterleiten, sodass die Krebszellen absterben. Ein weiterer Vorteil ist die sehr selektive Wirkung der Substanz: Während die Krebszellen effizient abgetötet werden, bleiben gesunde Körperzellen unversehrt. So führte der neuartige Eiweissstoff in Mäusen zur Auflösung der Tumore, ohne die Gesundheit der Tiere zu belasten.
Sehr wirksame Proteinverbindung bald an Patienten testen
Der Wirkstoff besteht aus mehreren sogenannten DARPins (Designed Ankyrin Repeat Proteins). Diese neue Klasse von Proteinverbindungen, die einfach herstellbar sind und über eine Vielzahl von günstig brauchbar geeigneten Bindungseigenschaften verfügen, entstand ebenfalls im Labor des Biochemikers Plückthun. Eine sehr ähnliche Substanz wird nun von Molecular Partners, einer Spin-off-Firma der Universität Zürich, weiterentwickelt. Ziel ist es, möglichst bald ein erstes Medikament, das nach diesem Wirkmechanismus funktioniert, in klinischen Studien am Menschen zu testen. Andreas Plückthun ist optimistisch «Nun, da die Achillesferse von HER2-positiven Krebszellen bekannt ist, eröffnen sich neue Perspektiven, um zukünftig aggressive Tumorarten wie Brustkrebs wirksamer behandeln zu können».
Literatur:
Rastislav Tamaskovic, Martin Schwill, Gabriela Nagy-Davidescu, Christian Jost, Dagmar C. Schaefer, Wouter P. R. Verdurmen, Jonas Schaefer, Annemarie Honegger, Andreas Plückthun. Intermolecular Trapping of ErbB2 Prevents Compensatory Activation of PI3K/AKT via RAS-p110 Crosstalk. Nature Communications. June 3, 2016. DOI: 10.1038/ncomms11672
Quelle: Universität Zürich
10.06.2016