Artikel • Automatisierung, AI & Co.
Was tut sich technisch beim Ultraschall?
Die Automatisierung in der Medizin nimmt weiter Fahrt auf, auch in der bildgebenden Diagnostik. Professor Christian Kollmann, Assistenz- Professor am Zentrum für Medizinische Physik und Biomedizinische Technik der Medizinischen Universität Wien zu innovativer Software, schneller Hardware und Artificial Intelligence beim Ultraschall – jetzt und in Zukunft.
Bericht: Marcel Rasch
Software wird bereits genutzt
Vor allem die automatisierten diagnostischen Auswertungsmethoden verfügen schon jetzt über softwaretechnische Unterstützung. Beim Doppler werden die Flussgeschwindigkeiten automatisch detektiert. Bei der B-Bildoptimierung im Grauwert-Verfahren werden gedämpfte Ultraschallwellen aus tieferen Gewebebereichen mithilfe spezifischer Algorithmen automatisch verstärkt. Auf Knopfdruck entsteht ein homogener Bildeindruck im gesamten Bildausschnitt.
Automatische Kompensation
Grundsätzlich wird als Ausbreitungsgeschwindigkeit beim Ultraschall ein konstanter Wert angenommen. In Abhängigkeit von der jeweiligen Gewebeart variiert sie aber und führt in der Folge zu Verzerrungen und suboptimaler Auflösung. Zu beobachten ist dies zum Beispiel bei Fettgewebe oder großen flüssigkeitsgefüllten Bereichen. Durch die automatische Anpassung der Ausbreitungsgeschwindigkeit über oder unter den eigentlichen Normwert kann dieses Problem kompensiert werden. „Das Feature ist der Einstellung des Autofokus bei der Digitalkamera nicht unähnlich und wird von einigen Herstellern angeboten“, erläutert Kollmann. Trotz aller Innovationen wäre die ärztliche Fachkompetenz aber unabdingbare Voraussetzung – denn nur so könne zwischen softwareimmanenten Artefakten und realen Befunden unterschieden werden.
Artificial Intelligence noch am Anfang
Damit tun sich ganz neue diagnostische Möglichkeiten auf
Christian Kollmann
Ein Anwendungsgebiet mit Potenzial für Algorithmen der künstlichen Intelligenz sieht Kollmann in der Quantifizierung und Klassifizierung von Gewebearten – zum Beispiel, um Tumoren zu erkennen und abzugrenzen. „Hier bewegen wir uns allerdings zurzeit noch im Bereich der Forschung.“ Die große Herausforderung bei der Quantifizierung und Segmentierung von Organen stellt die Darstellung von mehrschichtigen Bereichen mit vielen Gewebearten und in der Folge unterschiedlichen Rückstreuinformationen dar, was in einer Vielzahl unterschiedlichster Gewebeparameter kumuliert, die es zu evaluieren gilt. Beispiel Abdomen: „Um das einzelne Organ eindeutig abgrenzen und klassifizieren zu können, müssen zunächst die richtigen Positionsdaten, Dimensionen und Ebenen gefunden werden, dann spielen die Echoamplituden an den Gewebegrenzen eine große Rolle“, so Kollmann. Voraussetzung für eine ultraschnelle 3D-Darstellung sind drei Dinge: hochauflösende multigeplexte Matrixschallköpfe, eine schnelle Datenverarbeitung (hochentwickelte Computerchips) und exakte Segmentieralgorithmen. „Um Veränderungen, zum Beispiel aufgrund von Atmung heraus rechnen zu können, sind einige hundert oder sogar tausend frames per second in einer Ebene nötig“, schätzt Kollmann. Und weiter: „Damit tun sich ganz neue diagnostische Möglichkeiten auf, auch für den Doppler.“
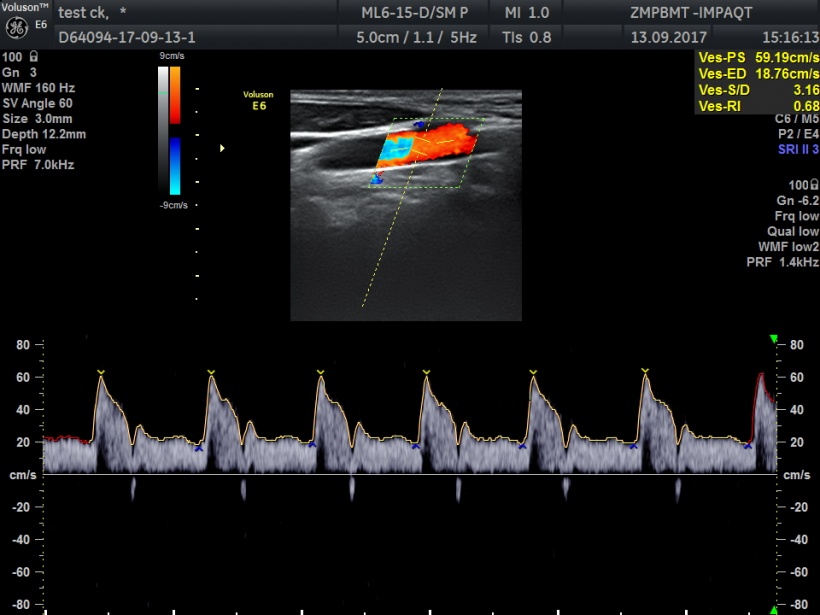
Diagnostisch wertvoll
Ein innovatives diagnostisches Verfahren ist das Vector-Velocity-Imaging. Es ermöglicht die dreidimensionale Darstellung der Flussgeschwindigkeit in Raum und Zeit. Komplexe Blutflussströmungen können damit unabhängig von der Schallkopforientierung gemessen und diagnostiziert werden. Ein Vektorpfeil zeigt dabei die Richtungsbewegungen der einzelnen Erythrocyten im Blutfluss eines Gefäßes an. Aufgrund der sehr schnellen Bildrate können Bewegungsmuster, wie zum Beispiel Verwirbelungen, innerhalb von Millisekunden nachvollzogen werden. Die diagnostische Relevanz liegt auf der Hand: Kritische Veränderungen werden bereits in einem frühen Stadium detektiert. „Dieses Verfahren wird Diagnostik und Quantifizierung mit Ultraschall in Angiologie und Kardiologie in den nächsten fünf bis zehn Jahren revolutionieren“, ist Kollmann überzeugt.
Multiparameter zur Klassifizierung
Um unterschiedliche Gewebearten und Tumoren noch besser klassifizieren zu können, werden zusätzliche Quantifizierungsparameter benötigt. Gestartet wurde vor Jahren mit der spektralbasierten Parametrisierung, um Fettlebern abschätzen zu können. Heute hat in der Klinik die Elastographie als Quantifizierungsinstrument Einzug gehalten. Beim Scherwellen-Imaging, wird die Geschwindigkeit der Scherwelle gemessen, um so Zusatzparameter für die Gewebeart zu bekommen. Der Rückstreukoeffizient dient als weiterer Parameter, vorausgesetzt, er liegt bereinigt um die Ausbreitungsverluste der Schallwelle vor. Weitere Statistiken sind in Erprobung. Mithilfe dieser Multi-Parameter, so die Idee, können auf Basis von Artificial-Intelligence-Algorithmen Klassifizierungen von Gewebetypen vorgenommen werden. „In diese Richtung wird es gehen“, ist Kollmann sicher. In Kombination mit anderen bildgebenden Verfahren gibt es bereits erfolgreiche Entwicklungen, die sogenannten Hybridverfahren: Die Photoakustik arbeitet mit zusätzlichen Informationsparametern vom Gewebe und mit der MR-gesteuerten-Ultraschalltherapie werden mittlerweile nicht nur Uterusmyome behandelt.
Ultraschall mit mobilen Endgeräten

Zurzeit werden Bildübertragungen in den Markt eingeführt, bei denen Schallköpfe drahtlos über WLAN an das Tablet gekoppelt werden. Denkbare Anwendungsgebiete sind Lehre und Ausbildung von Ärzten und Sonographern. Kollmann sieht hier ein großes Potenzial. Die APP wird auf IPad, IPhone oder Android-Tablet heruntergeladen und mithilfe des Schallkopfes in Manteltaschenformat kann geübt werden. „Bei Patienten bitte nur nach Einweisung und in kontrolliertem Maße“, betont Kollmann und macht auf die zwar nicht schädliche, aber doch zusätzliche Energie aufmerksam, die dem Organismus beim Schallen zugeführt wird. Auch der Einsatz am Point-of-care im Rahmen eines Notfallszenarios – Krankenwagen oder Hubschrauber – ist denkbar. Hinsichtlich der Datengeschwindigkeit sieht Kollmann keine ernsten Probleme mit Tablets und Smartphones. Selbst wenn, wie angekündigt, Farb- und Spektraldopplergeräte mit höherer Frame-Rate zur Anwendung kommen. „Über WLAN ist das technisch machbar, vorausgesetzt, die Signale werden komprimiert. Die Qualität ist jedenfalls ausreichend, um am POC den „Flow“ darzustellen“, so Kollmann abschließend.
Profil:
Professor Dr. Christian Kollmann ist Assistenzprofessor am Zentrum für Medizinische Physik und Biomedizinische Technik an der Medizinischen Universität in Wien. Seinen Doktortitel erwarb er in Technischer Physik an der Technischen Universität in Wien. Professor Kollmanns Spezialgebiet ist der medizinische Ultraschall. Er hat zwischen 1990 und 2017 über 140 Artikel in wissenschaftlichen Zeitschriften veröffentlicht und mehr als 200 Vorträge zu den Themen Ultraschall und biomedizinische Techniken gehalten.
Veranstaltungshinweise:
Raum: Seminar 3
Donnerstag, 12. Oktober 2017, 14:00 – 15:30
V 4.2 – Lehrphantome zur Ultraschall-Artefaktdarstellungen unter Nutzung von Rapid-Prototyping Verfahren
Christian Kollmann (Wien/AT)
Raum: Split-Meeting 6 + 7
Donnerstag, 12. Oktober 2017, 14:00 – 15:30
RK 14 Nerven am Hals
Technische Tipps & Tricks für die Nervensonographie
Christian Kollmann (Wien/AT)
13.10.2017