Quelle: Shutterstock/Bimbim
Artikel • Radiologie + Daten + KI = ?
Radiomics – wie geht das eigentlich?
Eines der spannendsten Themen, das derzeit bei interessierten Radiologen die Runde macht, ist Radiomics. Es geht dabei irgendwie um Daten und Künstliche Intelligenz (KI), soweit sind sich die meisten einig – die Details durchschauen allerdings nur Wenige.

Prof. Ulrike Attenberger will mit ihrem Vortrag auf dem Deutschen Röntgenkongress in Leipzig Abhilfe schaffen: „Wie geht eigentlich Radiomics?“, fragt die stellvertretende Institutsdirektorin und Geschäftsführende Oberärztin am Institut für Klinische Radiologie und Nuklearmedizin der Universitätsmedizin Mannheim. Vorab gibt sie einen Einblick, wie Radiomics die Radiologie künftig voranbringen kann und welche Hürden auf diesem Weg noch zu nehmen sind.
Zunächst der Versuch einer Definition: Bei Radiomics werden standardisierte und quantifizierte Charakteristika aus Bilddatensätzen der CT oder MRT – extrahiert. Aber was bedeutet das?
Aus Bildern werden Zahlen
Medizinische Bilddaten werden extrahiert, analysiert und gemodelt, um therapeutisch relevante Targets vorherzusagen – zum Beispiel Progressions- und Überlebensraten oder das Ansprechen eines Tumors auf eine bestimmte Therapie
Ulrike Attenberger
Die zentrale Idee hinter Radiomics ist die Extraktion standardisierter, quantitativer, mehrdimensionaler Informationen aus den Bilddaten mittels Verfahren der Künstlichen Intelligenz. Standardisierte, quantitative Informationen aus Bildern zu ziehen, ist derzeit das zentrale Thema: „Bislang hängt die Bewertung radiologischer Aufnahmen stark von der individuellen Erfahrung des Radiologen ab.“ Zur Klassifizierung eines Leberrundherdes werden etwa teilweise schwer greifbare Kriterien wie das Anflutungsverhalten eines Kontrastmittels herangezogen. Ein Laborwert dagegen liegt als Zahlen vor, es gibt Grenzwerte, die Normalzustand und Pathologie klar definieren und voneinander trennen – „so etwas gibt es in der Radiologie bislang nur in Ansätzen“, so Attenberger.
An diesem Punkt setzt Radiomics an. Mithilfe von KI-Techniken werden aus Bilddaten quantitative Informationen gezogen, die dann integrativ mit klinischen, molekularen und genetischen Daten bewertet werden können. „Man erhofft sich hierdurch eine genauere Prädiktion klinischer Endpunkte als es durch eine individuelle Analyse der Bilddaten möglich ist.“
Die standardisierte Quantifizierbarkeit der Bildinformation ist eine Grundvoraussetzung für eine personalisierte Medizin. Denn erst hierdurch lassen sich bildbasierte Biomarker entwickeln, erklärt Attenberger. Das geschieht durch den Radiomics Workflow: „Medizinische Bilddaten werden extrahiert, analysiert und gemodelt, um therapeutisch relevante Targets vorherzusagen – zum Beispiel Progressions- und Überlebensraten oder das Ansprechen eines Tumors auf eine bestimmte Therapie.“ Neben der Onkologie entdeckten Forscher das Potenzial dieser Technik unter anderem auch für die kardiologische Bildanalyse; hier können Radiomics-Anwendungen bereits die Differenzierung von kalzifizierten und nicht-kalzifizierten Plaques verbessern oder Patienten mit akuter Myokarditis verbessert identifizieren.
Dieser Artikel könnte Sie auch interessieren
Artikel • Therapiemonitoring
Wettlauf: Liquid Biopsy versus Radiomics
Die Entwicklung neuer Verfahren für präzises Therapiemonitoring in der Onkologie nimmt Fahrt auf. Die sogenannte Liquid Biopsy (Flüssigbiopsie) ist eines davon. Dank dieser neuen Labortechnik kann anhand einer Blutprobe nichtinvasiv freie Tumor-DNA identifiziert, charakterisiert und überwacht werden. Die Liquid Biopsy hat das Potenzial, die onkologische Diagnostik zu revolutionieren – und…
Vom Befunder zum Maschinen-Trainer
Radiomics ist in gewisser Weise die Weiterentwicklung der Computerassistierten Diagnose (CAD), so die Radiologin: „Es handelt sich um ein äußerst strukturiertes Verfahren – anstelle der optischen Klassifizierung auf Basis einer Läsion erfolgt ein dezidierter Analysealgorithmus, an dessen Beginn die Segmentierung einer Region-of-Interest (ROI) steht. Aus dieser extrahieren spezielle Algorithmen dann Charakteristika wie Textur- und Formanalyse oder Histogrammverteilung. Dieser Prozess kann unabhängig von der verwendeten bildgebenden Modalität angewandt werden.“
Wenn es um die Bedeutung von Radiomics geht, scheut sich Attenberger nicht, große Maßstäbe anzusetzen: „Das ist eine Revolution, die vergleichbar ist mit der Industrialisierung im 18. und 19. Jahrhundert. Wir müssen umdenken und unsere bisherigen Befundungsgewohnheiten von Grund auf verändern.“ Im Fokus steht nicht mehr das Bild an sich, sondern das Trainieren einer Maschine bzw. eines Algorithmus, der Informationen aus Bilddaten extrahiert, die für das menschliche Auge nicht erkennbar sind. Aus diesen Informationen kann der Computer Heatmaps erstellen, die Korrelationen der aus dem Bild generierten Informationen mit klinischen Daten, wie Outcome, Krankheitsverlauf oder Gendaten und Laborwerten herstellen. „Das ist ein äußerst komplexer, mehrstufiger Vorgang, bei dem unter anderem statistische Methoden eine wichtige Rolle spielen. Scheinbar paradoxerweise werden dabei viele Features reduziert, doch das ist nötig, um ein Overfitting zu vermeiden, also eine Überanpassung aufgrund der Berücksichtigung zu vieler Variablen, die zum Teil nur eine geringe Relevanz in Bezug auf die Fragestellung besitzen. Abschließend werden die Ergebnisse dieser „Trainings“ an neuen Datensätzen noch einmal validiert.“
Der heilige Gral und die Black Box
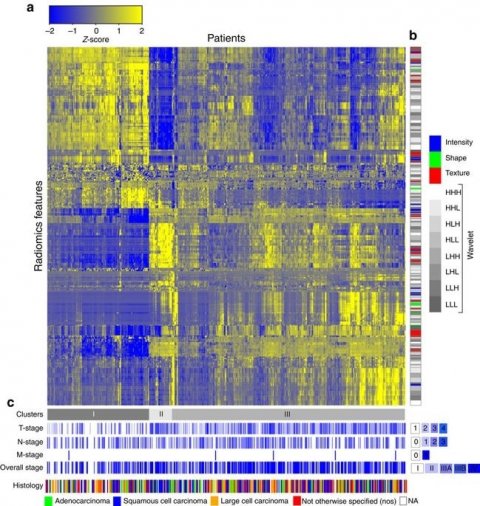
Radiomics heat map: (a) Unsupervised clustering of lung cancer patients (Lung1 set, n=422) on the y axis and radiomic feature expression (n=440) on the x axis, revealed clusters of patients with similar radiomic expression patterns. (b) Clinical patient parameters for showing significant association of the radiomic expression patterns with primary tumour stage (T-stage; P<1 × 10−20, χ2 test), overall stage (P=3.4 × 10−3, χ2 test) and histology (P=0.019, χ2 test). (c) Correspondence of radiomic feature groups with the clustered expression patterns.
Source: Hugo J. W. L. Aerts, Emmanuel Rios Velazquez, Ralph T. H. Leijenaar, Chintan Parmar, Patrick Grossmann et al.: Decoding tumour phenotype by noninvasive imaging using a quantitative radiomics approach; Nature Communications; © 2014, Springer Nature
Konsequenterweise stehen am Ende dieser Berechnungen Zahlen, die beschreiben, wie genau das trainierte Modell ist, um beispielsweise Rückschlüsse darüber zu geben, wie aggressiv ein untersuchter Tumor ist oder wie gut er auf eine bestimmte Therapieform ansprechen wird. Gerade letzterer Punkt ist jedoch nicht leicht festzumachen, wie die Expertin erklärt: „Das ist gewissermaßen noch ein heiliger Gral für die Anwendung. Zunächst muss modelliert werden, wie sich ein Tumor unter Therapie potentiell verändert. Das Delta quantifizierbarer Veränderungen vor und nach Therapie muss dann mit weiteren Variablen wie genetischen oder klinischen Daten korreliert werden. Daraus kann dann – so die Theorie – ein prädiktives Modell abgeleitet werden, das potentiell Vorhersagen zur Wirksamkeit liefern kann.“
Von der klinischen Anwendung ist dieser Ansatz jedoch noch ein ziemlich gutes Stück entfernt. Zuvor müssen etwa noch einheitliche Standards festgelegt werden, anhand derer neue Daten aufbereitet werden. „Dabei können allerdings schon Fortschritte verzeichnet werden, nicht zuletzt dank Projekten wie der Image Biomarker Standardisation Initiative (IBSI) oder der Radiomics Quality Score Initiative von Prof. Lambin aus Maastricht.“
KI könnte ein weiterer Weg sein, die Heterogenität der Protokolle auszugleichen, die einen allgemeingültigen Einsatz von Analyseverfahren derzeit unmöglich macht. Bevor Ansätze hierzu etabliert sind, zählt es zu den prominentesten Forderungen von Experten, die Quellcodes der Algorithmen in großen Datenbanken offenzulegen und die Verfahren damit reproduzierbar zu machen.
Damit Radiomics sein Potenzial voll ausspielen kann, ist Attenberger überzeugt, muss schon in der Facharztausbildung ganz neues Wissen vermittelt werden – etwa im Umgang mit Statistiken, Software-Programmierung, Segmentierung: „Die radiologische Ausbildung der Zukunft wird sehr viel Mathematik und Informatik enthalten müssen.“
Profil:
Prof. Ulrike Attenberger ist stellvertretende Institutsdirektorin und Geschäftsführende Oberärztin am Institut für Klinische Radiologie und Nuklearmedizin der Universitätsmedizin Mannheim. Nach dem Medizinstudium in München promovierte sie 2006 zum Thema „Stellenwert der MRT in der Diagnostik der pulmonalen Hypertonie“. Auch in ihrer Forschung liegt der Schwerpunkt auf der Magnetresonanztomographie, etwa bei der Tumordiagnostik sowie der Erfassung des Therapieansprechens. Prof. Attenberger wurde von der RSNA für ihre Arbeit zur Optimierung und Dosisreduktion kontrastverstärkter MR-Angiographien mit dem Fellow-Award ausgezeichnet und von der DRG mit dem Walter-Friedrich-Preis für ihre Habilitationsarbeit zum Thema: „Implementierung und Evaluation neuer Akquisitions- und Nachverarbeitungsverfahren zur Erweiterung des Anwendungsspektrums der Magnetresonanztomographie in der klinischen Routinediagnostik“.
30.05.2019