News • Feuer und Eis
Nanomedizin für sanftere Tumorbehandlung
Die Strahlentherapie ist einer der Eckpfeiler der Krebsbehandlung. Einige Tumorarten sprechen jedoch wenig bis kaum auf eine Bestrahlung an. Gelänge es, Tumorzellen empfindlicher zu machen, wäre die Behandlung wirksamer und sanfter. Forschenden ist es nun gelungen, Metalloxid-Nanopartikel als "Radiosensitizer" einzusetzen – und diese auch gleich im industriellen Massstab herzustellen.
Bei einer Krebserkrankung stehen heute verschiedene Behandlungsmethoden zur Verfügung, die sich ergänzen können. Häufig angewendet wird die Strahlentherapie, die etwa mit einer Operation und einer Chemotherapie kombiniert werden kann. Zwar wird die Behandlung mit ionisierenden Strahlen seit über 100 Jahren in der Medizin eingesetzt, doch auch die moderne Onkologie ist zuweilen nicht zufrieden mit ihrer Wirksamkeit. Der Grund: Die bösartigen Tumore reagieren nicht immer empfindlich genug auf die Strahlung. "Könnte die Empfindlichkeit der Tumorzellen gesteigert werden, liesse sich die Radiotherapie wirksamer und schonender ausführen", sagt Empa-Forscher Lukas Gerken, Forscher an der Empa und der ETH Zürich.
Will heissen: Ein erwünschtes Behandlungsziel könnte mit einer niedrigeren Strahlendosis als derzeit üblich erreicht werden oder besonders strahlungsresistente Tumore würden sogar endlich empfindlich für eine Bestrahlung. Das Team um Lukas Gerken und Inge Herrmann vom "Particles-Biology Interactions Laboratory" der Empa in St. Gallen und dem "Nanoparticle Systems Engineering Laboratory" der ETH Zürich sucht daher gemeinsam mit Onkologen am Kantonsspital St. Gallen nach Wegen, um Tumorzellen für die Bestrahlung zu sensibilisieren.
Die Forschenden haben Nanopartikel aus Metalloxiden ins Visier genommen, die als sogenannte Radiosensitizer wirken können. Dem Team ist es nun gelungen, diese Radiosensitizer in grossen Mengen herzustellen und ihre Wirkung genauer zu analysieren.

Quelle: Empa
Im Feuer gereift
In der Krebsforschung laufen derzeit Studien mit verschiedenen Stoffklassen, um die Bestrahlung von Tumoren effizienter zu machen. Wie genau hierbei Nanopartikel aus Gold oder aus exotischeren Metalloxiden wie Hafniumdioxid wirken, ist noch nicht völlig geklärt. Bekannt ist, dass eine komplexe Reaktionskaskade oxidativen Stress in den Krebszellen ausübt. Auf diese Weise lassen sich möglicherweise die Reparaturmechanismen der bösartigen Zellen überwältigen.
Damit die Nanopartikel für die klinische Anwendung bereitgestellt werden können, mussten zunächst zwei Hürden überwunden werden: Die Herstellung über konventionelle Nasschemie-Verfahren erschwert die Produktion von Mengen im industriellen Massstab, und es mangelt an vergleichenden Analysen zur Wirksamkeit verschiedener Substanzen.
Empa-Forscher Gerken ist es nun gelungen, Metalloxid-Radiosensitizer mit einer Methode herzustellen, die sich bestens für die industrielle Anwendung eignet: Er setzte auf die Flammensynthese, um Oxide aus Hafnium, Zirconium und Titan in höchster Qualität zu gewinnen. "Dank der Herstellungsart können – je nach Anlage – sogar mehrere Kilogramm am Tag synthetisiert werden", erklärt Gerken. Für die Laboranalysen an der Empa begnügte sich der Wissenschaftler allerdings mit einigen Gramm.
Besser als Gold

Nachdem die Nanopartikel in geeigneten Mengen vorlagen, konnte Lukas Gerken die "Kleinodien" detailliert durchleuchten, etwa mittels Röntgenspektroskopie und Elektronenmikroskopie. Sein Urteil: «Wir können sterile, qualitativ hochwertige Metalloxid-Nanopartikel erzeugen, die für gesunde Körperzellen ungefährlich erscheinen», erklärt der Forscher. Bewiesen hat er dies mit Hilfe von Zellkulturen, die er mit unterschiedlichen Nanopartikel-Suspensionen im Labor behandelte. Die Metalloxide sammelten sich dabei in grossen Mengen innerhalb der Zellen an. Spitzenreiter war dabei Hafniumdioxid: Hier gelangten eine halbe Milliarde Nano-Partikel in jede einzelne Zelle, ohne dabei giftig zu sein. Im Vergleich zu den Metalloxiden machte Nanogold bei gleicher Partikelgrösse einen deutlich schlechteren Schnitt: Etwa 10- bis 30-mal weniger Goldteilchen schafften es ins Zellinnere.
So ungefährlich die Substanzen zunächst für die gesunden Zellen sind, so kraftvoll entfalten sie ihre Wirkung, wenn sie bei einer Bestrahlung eingesetzt werden. Dies konnte das Team anhand von Krebszelllinien demonstrieren. Wurden die Zellkulturen mit Metalloxiden behandelt und danach mit Röntgenstrahlen beschossen, verstärkte sich der abtötende Effekt deutlich. Hafniumdioxid entpuppte sich als das potenteste Hilfsmittel: Tumorzellen, die mit Hafnium-Partikeln behandelt wurden, konnten schon mit weniger als der halben Strahlendosis beseitigt werden. Diese erste Vergleichstudie zeigte ausserdem, dass Hafniumdioxid sogar viermal besser als Nanogold und Titandioxid wirkt. Gesunde menschlichen Zellen (so genannte Fibroblasten) zeigten hingegen keine negativen Bestrahlungseffekte nach einer Nanopartikel-Behandlung.
Die Ergebnisse machen Lukas Gerken zuversichtlich: "Wir werden diesen Weg weiterverfolgen, um den Wirkmechanismus der Nanopartikel zu erforschen und ihre Effizienz weiter zu optimieren." Er hofft, dass seine Studien so die klinische Anwendung von Nanopartikeln bei der Bestrahlungstherapie voranbringen.
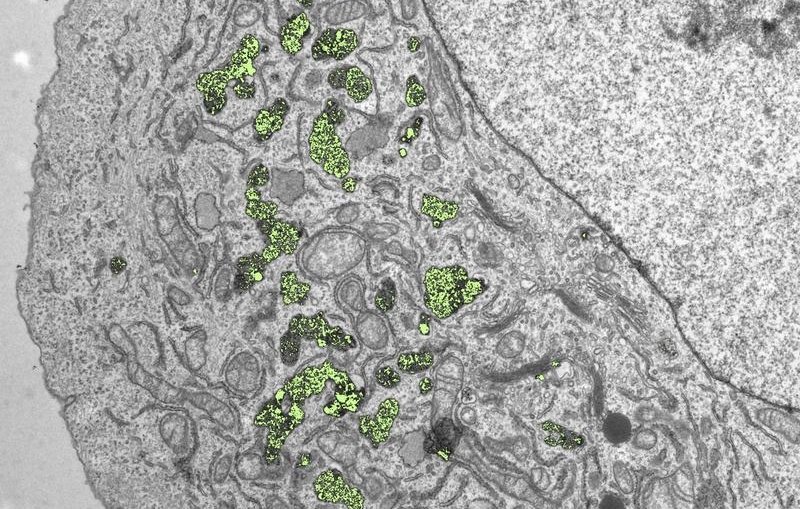
Bild: Empa/ ETH Zürich
Glänzendes Hilfsmittel
Das chemische Element Hafnium ist nach seinem Entdeckungsort Kopenhagen (lat. Hafnia) benannt. Der Chemiker und Nobelpreisträger George de Hevesy und der Physiker Dirk Coster konnten das Element aus der Titan-Gruppe 1923 endlich mittels Röntgenspektroskopie nachweisen, nachdem diverse Wissenschaftler wie etwa der Nobelpreisträger Niels Bohr dessen Existenz zuvor lediglich vermutet hatten. Hafnium kommt normalerweise nicht im menschlichen Körper vor und ist ungiftig. In der Onkologie hofft man auf die unterstützende Wirkung von Hafnium bei der Krebsbehandlung. Erste klinische Studien wurden bereits erfolgreich abgeschlossen.
Ihre Ergebnisse veröffentlichten die Forschenden im Fachmagazin "Chemistry of Materials".
Quelle: Empa - Eidgenössische Materialprüfungs- und Forschungsanstalt
11.03.2022