Artikel • Cyberknife
Gezielte Therapie beim metastasierten Prostatakarzinom mittels robotergestützter Radiochirurgie
Autoren: Dr. Sebastian Exner, Felix Behrens, PD Dr. Fabian Fehlauer
Prostatakrebs ist weltweit die zweithäufigste Krebserkrankung bei Männern.1 Nach der Erstbehandlung mit Strahlentherapie oder radikaler Prostatektomie entwickelt ein relevanter Anteil der Patienten Metastasen; nach der Erstbehandlung entwickeln 20–50% der Hochrisikopatienten biochemische Rezidive.2,3 Fortschritte bei der Diagnose sowie bei lokalen und systemischen Behandlungen haben die Ergebnisse bei Patienten mit Prostatakrebs verbessert.4,5 Die sofortige oder verzögerte Androgenentzugstherapie (ADT), Chemotherapie und palliative Strahlentherapie sind traditionell die Hauptstützen bei der Behandlung von metastasiertem Prostatakrebs.6
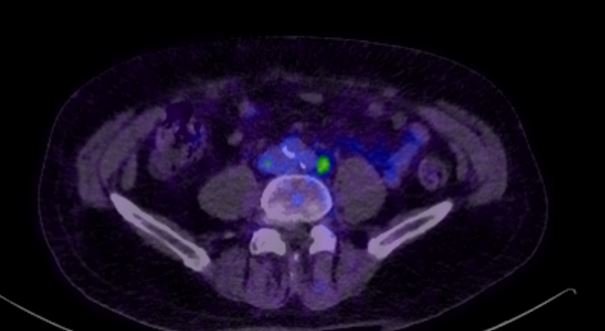
Zu den diagnostischen Verfahren zählen zunehmend die PET/CT, wobei derzeit vor allem das prostataspezifische Membranantigen (PSMA) für ein verbessertes lokales und systemisches Staging sowie zur Rezidivdiagnostik eingesetzt wird.7 PSMA ist ein Eiweißkörper, der auf der Zelloberfläche von Prostatakarzinomzellen vermehrt vorkommt. Durch Bindung einer mit Fluor-18 radioaktiv markierten Substanz an diese Struktur können Tumore sehr genau sichtbar gemacht und so auch sehr kleine Tumorherde nachgewiesen werden.8 Deshalb wird das PSMA-PET-CT sowohl von der deutschen S3-Leitlinie als auch von den Guidelines der European Association of Urology (EAU) zur Rezidivdiagnostik empfohlen.9,10 So können bereits bei niedrigen prostataspezifischen Antigenspiegeln (PSA) Rückfälle festgestellt werden.
In der Regel wird bei wiederkehrenden Erkrankungen eine Androgenentzugstherapie eingeleitet.7 Allerdings führen regelmäßige PSA-Kontrollen und eine verbesserte Bildgebung zunehmend zur Diagnose oligometastasierter Erkrankungen. Dabei stellt sich häufiger die Frage, ob eine Metastasen-gerichtete-Therapie (Metastases-directed therapy, MDT) oder die systemische Therapie das Mittel der Wahl in Bezug auf das progressionsfreie Überleben und Gesamtüberleben ist, insbesondere hinsichtlich der Lebensqualität.
1995 definierten Hellman und Weichselbaum das Konzept der metachronen Oligometastasierung. Dieses Paradigma besagt, dass bei bestimmten Tumoren bis zu einem gewissen Zeitpunkt nach der Erstdiagnose nur wenige Metastasen entstanden sind und, wenn diese entfernt werden, eine Heilung erreicht werden kann. Dieses Konzept wurde vor kurzem erweitert auf Patienten mit synchroner oligometastatischer Erkrankung (wenige Metastasen zum Zeitpunkt der Erstdiagnose) oder Patienten mit oligoprogressiver Erkrankung (definiert als Patienten, die unter einer Systemtherapie gut ansprechen bis auf wenige Metastasen, die stabil bleiben oder progressiv sind.11,12
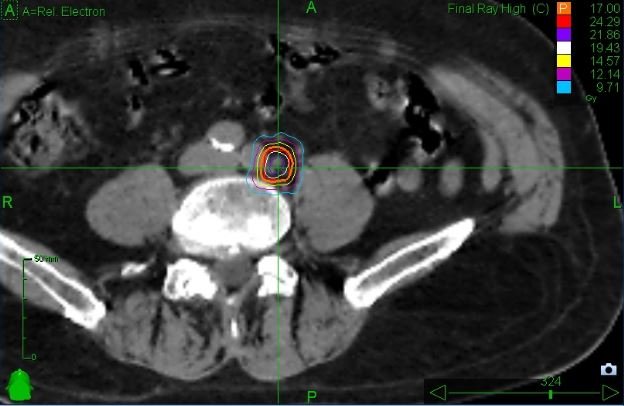
Die stereotaktische ablative Strahlentherapie (SABR) oder Radiochirurgie mittels Cyberknife therapiert mit einer sehr hohen Strahlendosis höchst konformal, wodurch im Tumor sehr viel Dosis und im gesunden Gewebe sehr wenig Dosis ankommt. Dies führt zu einer hohen lokalen Kontrolle mit nur wenigen bis keinen Nebenwirkungen. SABR ist eine ambulante, nicht-invasive lokale Therapie, die häufig zur Bekämpfung von Tumoren an verschiedenen Stellen wie Gehirn, Lunge, Leber, Lymphknoten und Knochen eingesetzt wird.12
Was eine oligometastatischen Erkrankung ist, ist nicht klar definiert und variiert von nur einer bis fünf Metastasen in einem bis drei Organen. Es häufen sich die Hinweise, dass die lokale MDT das Fortschreiten der Krankheit und den Einsatz systemischer Therapien verzögern kann. Dies kann helfen, die Nebenwirkungen einer Systemtherapie zu vermeiden und die Lebensqualität zu erhalten. Der Zeitpunkt der Diagnose einer oligometastasierten Erkrankung ist wahrscheinlich für den Erfolg der Metastasen-gezielten Therapie entscheidend.
Bei oligometastatischen Erkrankungen bietet die robotergestützte Radiochirurgie mit dem Cyberknife eine neue Möglichkeit für eine hoch-effektive Therapie bei ausgewählten Patienten mit dem Potenzial einer dauerhaften Krankheitskontrolle, ohne die systemische Therapie zu verzögern, da die Nebenwirkungen minimal sind und eine Therapiedauer von 1 bis 3 Sitzungen ausreicht. Weltweit nimmt der Einsatz von Radiochirurgie zu.13 Darüber hinaus ist die Kombination von Radiochirurgie mit neueren systemischen Therapien (z. B. Immun-Checkpoint-Inhibitoren) bei oligometastatischen Erkrankungen weit verbreitet und Gegenstand der aktuellen Forschung.14,15
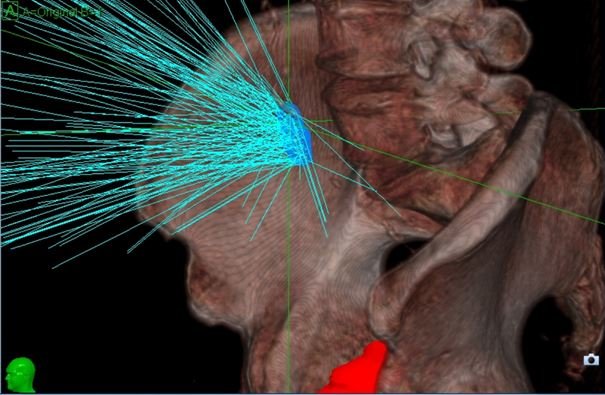
Bei Patienten mit metachronen Oligometastasen (Metastasen, die nach der Erstdiagnose diagnostiziert werden) bei hormonsensitivem Prostatakrebs ist die systemische Behandlung einschließlich ADT Behandlungsstandard. Dieses Konzept wurde jedoch kürzlich in prospektiven Phase-II-Studien in Frage gestellt, in denen eine lokale Behandlung angewendet wurde, um die ADT aufzuschieben.16,17
Baumann et al. untersuchten die metabolische Ansprechrate bei PSMA-PET/CT nach SABR von Knochenmetastasen mit 5 × 7 Gy.18 78% der bestrahlten Läsionen zeigten eine metabolische Reaktion im posttherapeutischen PSMA-PET/CT. Die metabolische Ansprechrate betrug 100%, wenn die Nachuntersuchung 5 Monate oder länger nach der Bestrahlung durchgeführt wurde. Folglich wurde ein Zeitintervall von mindestens 6 Monaten empfohlen. Welche Fraktionierung dabei gewählt werden sollte ist immer noch Gegenstand der Forschung. Ost et al. ermittelten ein besseres progressionsfreies Überleben bei einer biologischen effektiven Dosis (BED)> 100 Gy unter Verwendung eines α / β-Werts von 3 Gy.19
Zwei der größten bisher veröffentlichten prospektiven Studien, die den potenziellen Nutzen von SABR bei der Behandlung von oligometastatischem Prostatakrebs untersuchen, sind die ORIOLE- und STOMP- Studie. In der ORIOLE-Studie (Beobachtung vs. stereotaktische ablative Strahlung bei oligometastatischem Prostatakrebs) wurden 54 Patienten mit hormonsensitivem Prostatakarzinomrezidiv behandelt. Alle Patienten zeigten 1 – 3 Metastasen und 61% der Patienten zeigten nur Lymphknotenmetastasen. Eine biochemische oder klinische Progression nach 6 Monaten trat bei 19% der Patienten auf, die SABR erhalten hatten, und bei 61%, die einer Beobachtung unterzogen worden waren (p <0,01). Die vollständige Regression der PSMA-Avidität verringerte das Risiko für neue Läsionen nach 6 Monaten (16 vs. 63%; p <0,01). Daraus ergab sich die Hypothese, dass SABR eine systemische Immunantwort induziert (Abscopal-Effekt).17
In die STOMP-Studie (Surveillance oder MDT für das Wiederauftreten von oligometastatischem Prostatakrebs) wurden Patienten (n = 62) mit bis zu drei PET-positiven Metastasen eingeschlossen. Bei beiden Gruppen zeigten 55% der Patienten Lymphknotenmetastasen. Die MDT nutzte SABR (30 Gy in drei Fraktionen) bei den meisten Patienten (n = 25), aber auch Operationen (n = 6). Bei einer medianen Nachbeobachtungszeit von 3 Jahren betrug das mediane ADT-freie Überleben (primärer Endpunkt) 21 Monate in der MDT-Gruppe und 13 Monate in der Überwachungsgruppe. Im Metastasen-gezielten Therapiearm zeigten die mit SABR behandelten Patienten 1-Jahres-LC- und OS-Raten von 100% ohne akute und spättoxische Wirkungen.16
Größere Patientenzahlen mit einer längeren Nachbeobachtungszeit wurden in einer multi-institutionellen retrospektiven Fall-Kontroll-Studie für PET-detektierte Metastasen untersucht. In der MDT-Kohorte erhielten 166 Patienten eine Salvage-Lymphknotenresektion und 97 Patienten eine SABR. Die Standard-of-Care-Kohorte umfasste 1816 Patienten und wurde im Verhältnis 3: 1 mit der MDT-Kohorte verglichen. Nach einer medianen Nachbeobachtungszeit von 70 Monaten ergab sich für Patienten nach MDT ein signifikanter krebsspezifischer Überlebensvorteil (98,6 vs. 95,7% 5-Jahres-Überleben, p <0,01).20
Zusammenfassend lässt sich sagen, dass Patienten mit wenigen Metastasen bei der Erstdiagnose oder insbesondere im weiteren Verlauf der Nachsorge über die Möglichkeit einer Metastasen-gezielten Therapie informiert werden sollten.
Bei minimalen Nebenwirkungen kann eine exzellente lokale Kontrolle erzielt werden, die möglicherweise das Fortschreiten der Erkrankung komplett stoppt oder das Auftreten neuer Metastasen verzögert. Durch die verzögerte oder ausbleibende Systemtherapie können vielfältige, die Lebensqualität mindernde Nebenwirkungen vermieden werden. Dank regelmäßig durchgeführter Tumormarker-Kontrollen und wiederholter Bildgebung kann die Systemtherapie bei Progression jederzeit eingesetzt werden; sie wird durch die Radiochirurgie nicht behindert. Die Ergebnisse dieser Metastasen-gezielten Therapie beruhen auf einer Vielzahl von Studien und wurden erst kürzlich durch qualitativ hochwertige, prospektive Studien untermauert.
Quellen:
- Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018 Nov;68(6):394-424. doi: 10.3322/caac.21492. Epub 2018 Sep 12. Erratum in: CA Cancer J Clin. 2020 Jul;70(4):313. PMID: 30207593.
- Swanson GP, Riggs M, Hermans M. Pathologic findings at radical prostatectomy: risk factors for failure and death. Urol Oncol. 2007 Mar-Apr;25(2):110-4. doi: 10.1016/j.urolonc.2006.06.003. PMID: 17349524.
- Mottet N, Bellmunt J, Bolla M, Briers E, Cumberbatch MG, De Santis M, Fossati N, Gross T, Henry AM, Joniau S, Lam TB, Mason MD, Matveev VB, Moldovan PC, van den Bergh RCN, Van den Broeck T, van der Poel HG, van der Kwast TH, Rouvière O, Schoots IG, Wiegel T, Cornford P. EAU-ESTRO-SIOG Guidelines on Prostate Cancer. Part 1: Screening, Diagnosis, and Local Treatment with Curative Intent. Eur Urol. 2017 Apr;71(4):618-629. doi: 10.1016/j.eururo.2016.08.003. Epub 2016 Aug 25. PMID: 27568654.
- Yildirim BA, Onal C, Kose F, Oymak E, Sedef AM, Besen AA, Aksoy S, Guler OC, Sumbul AT, Muallaoglu S, Mertsoylu H, Ozyigit G. Outcome of loco-regional radiotherapy in metastatic castration-resistant prostate cancer patients treated with abiraterone acetate. Strahlenther Onkol. 2019 Oct;195(10):872-881. English. doi: 10.1007/s00066-019-01429-6. Epub 2019 Jan 30. PMID: 30701292.
- Ozyigit G, Onal C, Igdem S, Alicikus ZA, Iribas A, Akin M, Yalman D, Cetin I, Aksu MG, Atalar B, Dincbas F, Hurmuz P, Guler OC, Aydin B, Sert F, Yildirim C, Gorken IB, Agaoglu FY, Korcum AF, Yuce D, Ozkok S, Darendeliler E, Akyol F. Treatment outcomes of prostate cancer patients with Gleason score 8-10 treated with definitive radiotherapy : TROD 09-001 multi-institutional study. Strahlenther Onkol. 2019 Oct;195(10):882-893. English. doi: 10.1007/s00066-019-01476-z. Epub 2019 May 29. PMID: 31143994.
- Cornford P, Bellmunt J, Bolla M, Briers E, De Santis M, Gross T, Henry AM, Joniau S, Lam TB, Mason MD, van der Poel HG, van der Kwast TH, Rouvière O, Wiegel T, Mottet N. EAU-ESTRO-SIOG Guidelines on Prostate Cancer. Part II: Treatment of Relapsing, Metastatic, and Castration-Resistant Prostate Cancer. Eur Urol. 2017 Apr;71(4):630-642. doi: 10.1016/j.eururo.2016.08.002. Epub 2016 Aug 31. PMID: 27591931.
- Walacides D, Meier A, Knöchelmann AC, Meinecke D, Derlin T, Bengel FM, Ross TL, Wester HJ, Derlin K, Kuczyk MA, von Klot CAJ, Christiansen H, Henkenberens C. Comparison of 68Ga-PSMA ligand PET/CT versus conventional cross-sectional imaging for target volume delineation for metastasis-directed radiotherapy for metachronous lymph node metastases from prostate cancer. Strahlenther Onkol. 2019 May;195(5):420-429. English. doi: 10.1007/s00066-018-1417-9. Epub 2019 Jan 4. PMID: 30610354.
- Perera M, Papa N, Roberts M, Williams M, Udovicich C, Vela I, Christidis D, Bolton D, Hofman MS, Lawrentschuk N, Murphy DG. Gallium-68 Prostate-specific Membrane Antigen Positron Emission Tomography in Advanced Prostate Cancer-Updated Diagnostic Utility, Sensitivity, Specificity, and Distribution of Prostate-specific Membrane Antigen-avid Lesions: A Systematic Review and Meta-analysis. Eur Urol. 2020 Apr;77(4):403-417. doi: 10.1016/j.eururo.2019.01.049. Epub 2019 Feb 14. PMID: 30773328.
- Leitlinienprogramm Onkologie (Deutsche Krebsgesellschaft, Deutsche Krebshilfe, AWMF): Interdisziplinäre Leitlinie der Qualität S3 zur Früherkennung, Diagnose und Therapie der verschiedenen Stadien des Prostatakarzinoms, Langversion 5.1, 2019, AWMF Registernummer: 043/022OL
- Mottet N et al.: EAU - ESTRO -ESUR - SIOG Guidelines on prostate cancer 2020.
- Hellman S, Weichselbaum RR. Oligometastases. J Clin Oncol. 1995 Jan;13(1):8-10. doi: 10.1200/JCO.1995.13.1.8. PMID: 7799047.
- Lievens Y, Guckenberger M, Gomez D, Hoyer M, Iyengar P, Kindts I, Méndez Romero A, Nevens D, Palma D, Park C, Ricardi U, Scorsetti M, Yu J, Woodward WA. Defining oligometastatic disease from a radiation oncology perspective: An ESTRO-ASTRO consensus document. Radiother Oncol. 2020 Jul;148:157-166. doi: 10.1016/j.radonc.2020.04.003. Epub 2020 Apr 22. PMID: 32388150.
- Lewis SL, Porceddu S, Nakamura N, Palma DA, Lo SS, Hoskin P, Moghanaki D, Chmura SJ, Salama JK. Definitive Stereotactic Body Radiotherapy (SBRT) for Extracranial Oligometastases: An International Survey of >1000 Radiation Oncologists. Am J Clin Oncol. 2017 Aug;40(4):418-422. doi: 10.1097/COC.0000000000000169. PMID: 25647831.
- Bernstein MB, Krishnan S, Hodge JW, Chang JY. Immunotherapy and stereotactic ablative radiotherapy (ISABR): a curative approach? Nat Rev Clin Oncol. 2016 Aug;13(8):516-24. doi: 10.1038/nrclinonc.2016.30. Epub 2016 Mar 8. PMID: 26951040; PMCID: PMC6053911.
- Lehrer EJ, Peterson J, Brown PD, Sheehan JP, Quiñones-Hinojosa A, Zaorsky NG, Trifiletti DM. Treatment of brain metastases with stereotactic radiosurgery and immune checkpoint inhibitors: An international meta-analysis of individual patient data. Radiother Oncol. 2019 Jan;130:104-112. doi: 10.1016/j.radonc.2018.08.025. Epub 2018 Sep 18. PMID: 30241791.
- Ost P, Reynders D, Decaestecker K, Fonteyne V, Lumen N, De Bruycker A, Lambert B, Delrue L, Bultijnck R, Claeys T, Goetghebeur E, Villeirs G, De Man K, Ameye F, Billiet I, Joniau S, Vanhaverbeke F, De Meerleer G. Surveillance or Metastasis-Directed Therapy for Oligometastatic Prostate Cancer Recurrence: A Prospective, Randomized, Multicenter Phase II Trial. J Clin Oncol. 2018 Feb 10;36(5):446-453. doi: 10.1200/JCO.2017.75.4853. Epub 2017 Dec 14. PMID: 29240541.
- Phillips R, Shi WY, Deek M, Radwan N, Lim SJ, Antonarakis ES, Rowe SP, Ross AE, Gorin MA, Deville C, Greco SC, Wang H, Denmeade SR, Paller CJ, Dipasquale S, DeWeese TL, Song DY, Wang H, Carducci MA, Pienta KJ, Pomper MG, Dicker AP, Eisenberger MA, Alizadeh AA, Diehn M, Tran PT. Outcomes of Observation vs Stereotactic Ablative Radiation for Oligometastatic Prostate Cancer: The ORIOLE Phase 2 Randomized Clinical Trial. JAMA Oncol. 2020 May 1;6(5):650-659. doi: 10.1001/jamaoncol.2020.0147. PMID: 32215577; PMCID: PMC7225913.
- Baumann R, Koncz M, Luetzen U, Krause F, Dunst J. Oligometastases in prostate cancer : Metabolic response in follow-up PSMA-PET-CTs after hypofractionated IGRT. Strahlenther Onkol. 2018 Apr;194(4):318-324. doi: 10.1007/s00066-017-1239-1. Epub 2017 Nov 27. PMID: 29181556; PMCID: PMC5869895.
- Ost P, Jereczek-Fossa BA, As NV, Zilli T, Muacevic A, Olivier K, Henderson D, Casamassima F, Orecchia R, Surgo A, Brown L, Tree A, Miralbell R, De Meerleer G. Progression-free Survival Following Stereotactic Body Radiotherapy for Oligometastatic Prostate Cancer Treatment-naive Recurrence: A Multi-institutional Analysis. Eur Urol. 2016 Jan;69(1):9-12. doi: 10.1016/j.eururo.2015.07.004. Epub 2015 Jul 16. PMID: 26189689.
- Steuber T, Jilg C, Tennstedt P, De Bruycker A, Tilki D, Decaestecker K, Zilli T, Jereczek-Fossa BA, Wetterauer U, Grosu AL, Schultze-Seemann W, Heinzer H, Graefen M, Morlacco A, Karnes RJ, Ost P. Standard of Care Versus Metastases-directed Therapy for PET-detected Nodal Oligorecurrent Prostate Cancer Following Multimodality Treatment: A Multi-institutional Case-control Study. Eur Urol Focus. 2019 Nov;5(6):1007-1013. doi: 10.1016/j.euf.2018.02.015. Epub 2018 Mar 10. PMID: 29530632.
23.06.2021