News • Sphingomyelin-Visualisierung
Neues Werkzeug für die Infektionsforschung
Forschende aus Würzburg und Berlin stellen neue Moleküle zur Visualisierung des Sphingomyelin-Stoffwechsels vor. Der Infektionsforschung bietet das Perspektiven für innovative Therapieansätze.
Bildquelle: Jürgen Seibel / Universität Würzburg
Die Studie ist in der Fachzeitschrift „Nature Communications“ veröffentlicht worden.
Ende des 19. Jahrhunderts isolierte der deutsche Pathologe Ludwig Thudichum bisher unbekannte Fettstoffe (Lipide) aus dem Gehirn. Er nannte die neue Klasse von Molekülen Sphingolipide – nach dem griechischen Fabelwesen Sphinx, aus Respekt vor „den vielen Rätseln, die sie dem Forscher aufgab“.
Seitdem sind zahlreiche Krankheiten entdeckt worden, die durch einen gestörten Sphingolipid-Stoffwechsel im Gehirn verursacht werden, darunter Morbus Fabry und Morbus Gaucher. Sphingolipide wurden auch mit Infektionskrankheiten in Verbindung gebracht, zum Beispiel mit Virusinfektionen wie Ebola, Masern oder Covid-19, sowie mit bakteriellen Infektionen durch Pseudomonas aeruginosa oder Staphylococcus aureus, die Mittelohrentzündungen, Haut- und Lungeninfektionen und viele andere Krankheiten zur Folge haben können. Bei diesen Infektionen ist oft der Abbau des Moleküls Sphingomyelin durch das Enzym Sphingomyelinase entscheidend. Bisher war es jedoch schwierig, die Aktivität des Enzyms zu visualisieren.
Neu entwickelte Moleküle machen dies nun möglich. Forschenden aus Würzburg und Berlin ist es gelungen, ein Sphingomyelin-Derivat zu entwickeln, mit dem sich die Verteilung von Sphingomyelin sowie die Aktivität der Sphingomyelinase bei Infektionsprozessen sichtbar machen lassen.
Unser Ziel ist es, [mit dem Werkzeug] neue anti-infektiöse oder immuntherapeutische Strategien für die Medikamentenentwicklung zu identifizieren, die durch Modulation des Sphingolipid-Stoffwechsels zur Bekämpfung von Infektionskrankheiten eingesetzt werden können
Jürgen Seibel
Die Wissenschaftler sind Teil des von der Deutschen Forschungsgemeinschaft (DFG) geförderten Graduiertenkollegs 2581 „Metabolismus, Topologie und Kompartimentierung von membranständigen Lipid- und Signalkomponenten bei Infektionen“. Darin arbeiten Forschende aus Chemie, Physik und Biologie zusammen, um neue chemische Verbindungen zu synthetisieren und ihre Anwendbarkeit in der Infektionsforschung zu erproben. „Bei den neuen Molekülen handelt es sich um trifunktionale Sphingomyeline auf Basis des Naturstoffs Sphingomyelin, der noch mit drei zusätzlichen Funktionen ausgestattet wurde. Es war schwierig, einen so hoch-funktionalisierten Naturstoff zu designen, der wie der ursprüngliche Naturstoff von dem Metabolismus erkannt und genutzt wird“, sagt Professor Jürgen Seibel vom Institut für Organische Chemie der Julius-Maximilians-Universität Würzburg.
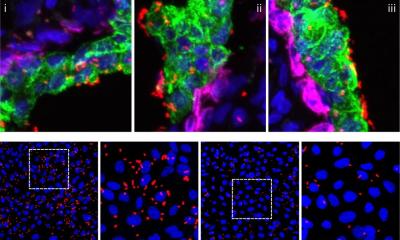
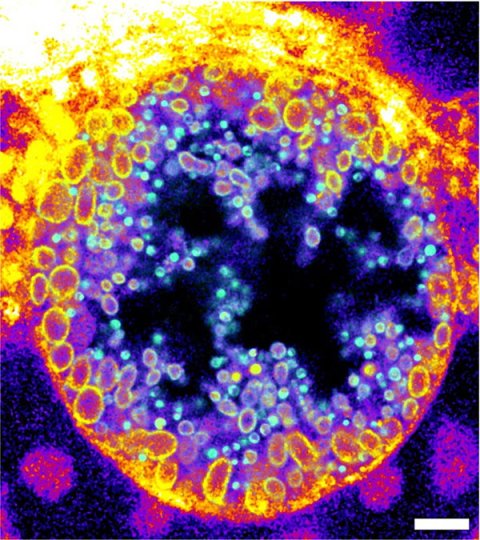
Die Wissenschaftler testeten die Funktion der von ihnen neu entwickelten Moleküle, indem sie etwa die Aktivität einer bakteriellen Sphingomyelinase auf der Oberfläche menschlicher Zellen bestimmten. Weiterhin visualisierten sie den Sphingomyelin-Abbau innerhalb menschlicher Zellen während einer intrazellulären Infektion von menschlichen Zellen mit Chlamydia-Bakterien. Chlamydien infizieren unter anderem den menschlichen Genitaltrakt, stehen aber auch im Verdacht, in infizierten Geweben zur Entstehung von Krebs in beizutragen.
Innerhalb ihrer Wirtszellen bilden Chlamydien eine replikative Organelle, die als Inklusion (Einschluss) bezeichnet wird. Die Forschenden zeigten, dass Chlamydien-Inklusionen hauptsächlich die gespaltenen Formen der trifunktionalen Sphingomyeline enthalten. Mit Hilfe der Expansionsmikroskopie und Click-Chemie beobachteten sie, dass der Anteil der verstoffwechselten Sphingomyelinmoleküle während der Entwicklung von nicht-infektiösen zu infektiösen Chlamydienpartikeln zunahm. Durch die Möglichkeit, diesen Infektionsprozess sichtbar zu machen, können nun neue gezielte Strategien gegen diese Infektionen entwickelt und getestet werden.
„Das neue chemische Werkzeug wird uns sicherlich gute Dienste leisten und kann in vielen Labors eingesetzt werden“, so Professor Seibel. „Unser Ziel ist es, damit neue anti-infektiöse oder immuntherapeutische Strategien für die Medikamentenentwicklung zu identifizieren, die durch Modulation des Sphingolipid-Stoffwechsels zur Bekämpfung von Infektionskrankheiten eingesetzt werden können.“
Quelle: Julius-Maximilians-Universität Würzburg
02.09.2024