
© Fraunhofer ITEM
News • Medikamentenforschung
Herz-Organoide mit Immunsystem zeigen Kardiotoxizität
Neuentwickelte Wirkstoffe sind ein Hoffnungsträger im Kampf gegen Volkskrankheiten wie Krebs, können allerdings das Herz-Kreislaufsystem beeinträchtigen und scheitern daher oft schon in der Entwicklung.
Forschende des Fraunhofer-Instituts für Toxikologie und Experimentelle Medizin ITEM und der Medizinischen Hochschule Hannover haben ein komplexes Herzorganoid-Modell entwickelt, an dem sich die potenzielle Kardiotoxizität neuer Medikamente erforschen lässt. Das Miniherz verfügt sogar über ein eigenes Immunsystem.
Kardiotoxizität bezeichnet schädliche Wirkungen eines Medikaments auf das Herz, die zu Herzrhythmusstörungen, Kardiomyopathien oder anderen kardiovaskulären Komplikationen führen können. Sie ist eine der Hauptursachen für das Scheitern von Wirkstoffen während der Entwicklungsphase oder für deren Rückruf vom Markt. Ein zentrales Problem ist die unzureichende Vorhersagbarkeit kardiotoxischer Effekte in präklinischen Modellen. In herkömmlichen Zellkulturen lässt sich die potenzielle Kardiotoxizität neuer Medikamente, unter anderem auch die von modernsten Immun- und Zelltherapeutika aufgrund der erforderlichen Komplexität nur unzureichend untersuchen und simulieren. Um diesem Problem zu begegnen, haben Forscher des Fraunhofer ITEM und der Medizinischen Hochschule Hannover unter der Beteiligung der Fraunhofer-Institute für Zelltherapie und Immunologie IZI und für Silicatforschung ISC ein neuartiges Herzorganoid-Modell mit einem eigenen Immunsystem entwickelt, das die Eigenschaften des menschlichen Herzens in seiner (patho-)physiologischen Komplexität besser abbildet. Das humane kardiale Organoid kann daher zur Modellierung von Kardiotoxizität dienen, deren Erforschung essenziell für die Entwicklung und Testung von neuen Medikamenten ist. "Prinzipiell lässt sich mit unserem Modell die Kardiotoxizität jedes Medikaments überprüfen", sagt Prof. Dr. Christian Bär, Wissenschaftler am Fraunhofer ITEM. "Dies ist insofern ein großer Vorteil, als viele Arzneien in späten Phasen der präklinischen Entwicklung aufgrund ihrer kardiotoxischen Wirkung scheitern und nicht zugelassen werden können. Mit unserem Herzorganoid lässt sich daher viel Zeit und Geld sparen."
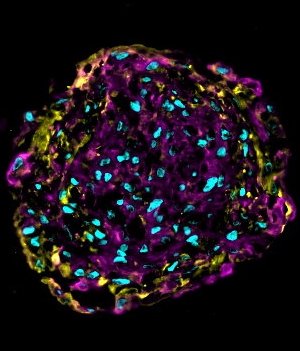
© Fraunhofer ITEM
Die funktionellen Organoide, oder Miniherzen, die deutlich kleiner als ein Stecknadelkopf sind, bestehen aus Herzmuskelzellen (Kardiomyozyten), kardialen Fibroblasten (Bindegewebszellen) und Endothelzellen (Gefäßzellen), die allesamt von induzierten pluripotenten menschlichen Stammzellen (hiPSC) stammen sowie aus mesenchymalen Stammzellen. HiPSCs sind embryonalen Stammzellen sehr ähnlich, sie werden jedoch im Labor aus adulten Zellen, die zuvor dem Bindegewebe oder Blut von Erwachsenen entnommen wurden, gezüchtet und reprogrammiert. "Wir differenzieren induzierte pluripotente Stammzellen in Herzmuskelzellen, Fibroblasten und Endothelzellen aus. Anschließend mischen wir diese in einem bestimmten Verhältnis mit mesenchymalen Stammzellen und pipettieren den Zellmix in eine Agaroseform, die wir in eine Zellkulturschale stellen", erläutert Elisa Mohr, Wissenschaftlerin an der Medizinischen Hochschule Hannover und am Fraunhofer ITEM. Dabei organisieren sich die einzelnen Zellen selbst und bilden innerhalb von vier Tagen eine kugelförmige, ca. 200 Mikrometer große Organoid-Struktur, die spontan anfängt zu schlagen wie ein Miniherz. Ein Organoid umfasst rund 2 000 Zellen. Das Miniherz lässt sich darüber hinaus auch per Elektrostimulation vergleichbar einem Herzschrittmacher zur Kontraktion anregen.
Die Zugabe der Makrophagen und somit die Integration von Immunkompetenz in das Herzorganoid ermöglicht es uns, noch näher am Menschen und translationaler zu forschen
Elisa Mohr
Eine potenzielle Kardiotoxizität neuer Wirkstoffe lässt sich mit den Organoiden vielseitig durch hochaufgelöste Analyse des Schlagverhaltens, durch klassische Histologie sowie modernste Genexpressionsanalysen auf Einzelzellebene überprüfen. Über die Kardiotoxizität hinaus sind die Forschenden mit den humanen kardialen Organoiden in der Lage, unterschiedliche kardiovaskuläre Erkrankungen wie den Herzinfarkt (Myokardinfarkt), Herzrhythmusstörungen oder die kardiale Hypertrophie, eine Verdickung des Herzmuskels, zu modellieren. "Wir können das Herzorganoid quasi als humanes Testsystem nutzen", so Bär. Da sich die Organoide über den Zeitraum von mindestens dreißig Tagen kultivieren lassen, sind Experimente mit chronischen Versuchsaufbauten möglich. Dazu gehören auch Untersuchungen neuartiger Wirkstoffklassen wie RNA-Therapien.
Mit ihren Krankheitsmodellierungsansätzen konnte das Forscherteam nachweisen, dass die Kontraktilität der Herzorganoide medikamentös beeinflussbar ist. Hierzu haben die Forschenden Herzorganoide mit krankhaften Kardiomyozyten hergestellt, welche aus hiPSC differenziert wurden, die von Patienten mit hypertropher Kardiomyopathie gewonnen wurden. "In unseren Experimenten konnten wir aber auch zeigen, dass Mavacamten, ein neu zugelassenes Medikament für die hypertrophe Kardiomyopathie, eine genetisch bedingte Herzerkrankung, die Kontraktilität des Herzmuskels verbessert, den zu starken Herzschlag beruhigt, aber nicht kardiotoxisch wirkt", sagt Mohr.
Derzeit arbeitet das Forscherteam daran, die Organoide mit einem Immunsystem auszustatten. Dies gelingt mit Makrophagen, die aus induzierten pluripotenten Stammzellen ausdifferenziert wurden, also Designer-Immunzellen. Dem Fraunhofer ITEM-Forscher Prof. Dr. Nico Lachmann ist es gelungen, reife Immunzellen wie Makrophagen in skalierbaren Systemen herzustellen, also vom kleinen Labormaßstab bis hin zur industriellen Verwendung. Als wichtiger Teil der menschlichen Immunantwort bekämpfen Makrophagen, also Fresszellen, zum Beispiel Bakterien. Das Beimischen dieses neuen Zelltyps verbessert nachgewiesenermaßen die Funktion des künstlichen Herzgewebes. "Die Zugabe der Makrophagen und somit die Integration von Immunkompetenz in das Herzorganoid ermöglicht es uns, noch näher am Menschen und translationaler zu forschen", resümiert Mohr.
Quelle: Fraunhofer-Institut für Toxikologie und Experimentelle Medizin
05.05.2025





