Struktur
Hantavirus-Proteins Vorlage für Medikamenten-Design
Gegen die Infektion mit einem gefährlichen Hantavirus gibt es kein Heilmittel. Wissenschaftler vom Max-Delbrück-Centrum für Molekulare Medizin (MDC) konnten nun die dreidimensionale Struktur eines Hantavirus-Proteins aufklären, das für dessen Vermehrung essentiell ist. Sie veröffentlichten ihre Ergebnisse im Fachjournal Cell Reports und stellen damit eine Vorlage bereit, in die neue Medikamente wie Puzzlestücke eingepasst werden können.

Der Kot der Rötelmaus kann einen gefährlichen Vertreter aus der Gruppe der Hantaviren enthalten. Während der Nager von der eigenen Infektion nichts merkt, können Hantaviren im Menschen teilweise tödlich verlaufende Erkrankungen verursachen, für die keine Therapie existiert. In Mittel- und Nordeuropa zeichnet sich die Krankheit durch Fieber, Kopf- und Gliederschmerzen und Nierenversagen aus. Die in Ostasien auftretende Art des Virus, sie heißt Hantaan-Virus, ist noch gefährlicher: Bis zu fünf Prozent der Infektionen enden dort nach hämorrhagischem Fieber, Nierenversagen oder schweren Lungenerkrankungen tödlich.
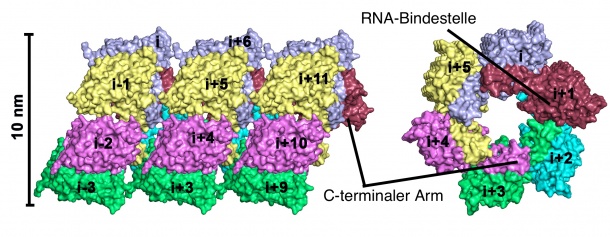
Dr. Daniel Olal und Prof. Oliver Daumke vom MDC in Berlin haben nun das sogenannte Nukleoprotein des Hantaan-Virus mit Hilfe von Röntgenkristallographie analysiert und dessen dreidimensionale Struktur aufgeklärt. Sie fanden heraus, dass sich einzelne Nukleoproteine in Anwesenheit von Erbgutmolekülen zusammenlagern und sechszählige, ringförmige Komplexe bilden. „Wir kennen bereits zelluläre Abwehrmechanismen, die das Virenwachstum hemmen. Wir denken, dass die Erkennung von ringförmigen Strukturen dabei eine Rolle spielen könnte“, sagt Olal.
Das Nukleoprotein ist unter anderem für die Vervielfältigung des viralen Erbguts wichtig. Ist seine Funktion gestört, gibt es keine funktionierenden Viruspartikel. Daher ist dieses Protein eine ideale Zielstruktur für zukünftige Medikamente. „Unsere Struktur könnte für das Design von kleinen Molekülen dienlich sein, die spezifisch das Nukleoprotein blockieren“ sagt Olal. Als Andockstellen für solche Chemikalien bieten sich drei Bindetaschen an, die die Forscher auf der Oberfläche des Proteins identifizierten. Olal schätzt die Chancen, dass solche Medikamente zukünftig entwickelt werden, als realistisch ein: „Die Technologien für das Finden von Kandidaten für die Medikamentenentwicklung werden immer besser.“
Quelle: Max-Delbrück-Center für Molekulare Medizin
10.03.2016