Quelle: Universität des Saarlandes
News • Krankenhauskeime
Die Gründe für verschiedene Haftmechanismen von Bakterien
In Krankenhäusern sind multiresistente Bakterien eine ständige Bedrohung. Dort können sie zum Beispiel Türgriffe und Lichtschalter besiedeln und auf Implantaten zu schweren Infektionen führen. Ein Team der Physik der Universität des Saarlandes hat jetzt gezeigt, warum die Krankenhauskeime besonders gut an Materialien haften, von denen Wasser abperlt und besonders schlecht an Oberflächen, die von Wasser benetzt werden. Diese Forschungsergebnisse aus der experimentellen und theoretischen Physik können helfen, antibakterielle Oberflächen zu verbessern.
Bakterien der Art Staphylococcus aureus sind eine der häufigsten Ursachen für Infektionen, die Patienten während eines Krankenhausaufenthaltes bekommen. Die Erreger werden besonders gefürchtet, weil sie auf natürlichen und künstlichen Oberflächen robuste Biofilme bilden können, die nur schwer zu entfernen sind. „Die einzelnen Bakterien sind in diesen Biofilmen selbst gut geschützt vor Antibiotika und der menschlichen Immunabwehr. Daher ist es so gefährlich, wenn sie sich zum Beispiel auf Implantaten ansiedeln und nach einer Operation dort Infektionen verursachen“, erläutert Karin Jacobs, Professorin für Experimentalphysik der Universität des Saarlandes. Wichtig sei es daher, die Bildung von Biofilmen von vornherein zu verhindern.
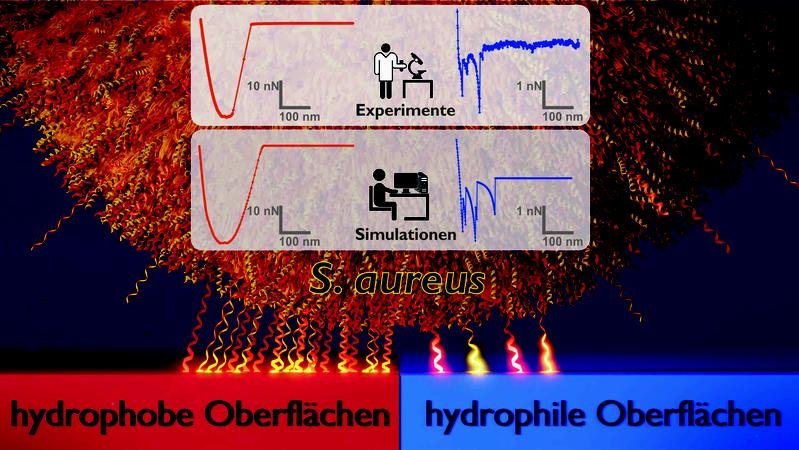
Dazu mussten die Saarbrücker Forscher aber zuerst die Mechanismen verstehen, mit denen Bakterien an verschiedenen Materialien haften. Mit Hilfe eines Rasterkraftmikroskops drückten sie die winzigen Bakterienzellen auf verschiedene Oberflächen und bestimmten dabei die Kraft, die erforderlich war, um die Zellen wieder abzulösen. In den Experimenten wurden so genannte Kraft-Distanz-Kurven aufgenommen. „Als Modelloberflächen haben wir extrem glatte Siliziumoberflächen verwendet, die einmal so präpariert wurden, dass sie gut von Wasser benetzt werden und einmal so, dass sie wasserabweisend sind. Dabei stellte sich heraus, dass die Zellen auf hydrophoben Oberflächen, also denen, die Wasser abweisen, deutlich stärker haften als auf hydrophilen, gut benetzbaren Oberflächen“, erklärt Karin Jacobs. Aber nicht nur die Haftkräfte, sondern auch die Formen der Kraft-Distanz-Kurven unterscheiden sich grundlegend zwischen den beiden Oberflächen (siehe Abbildung): Auf den hydrophoben Oberflächen erhalten wir sehr glatte Kurven mit charakteristischer “Tassen-Form“. Auf den hydrophilen Oberflächen hingegen zeigen sich individuelle Kurvenformen mit zahlreichen „Zacken“.
Dieser Artikel könnte Sie auch interessieren

Artikel • Oberflächendesinfektion bei Covid-19
SARS-CoV-2: Hartnäckig und langlebig – aber nicht unverwundbar
Oberflächendesinfektion hat sich als eine effektive Präventionsmaßnahme gegen Covid-19 erwiesen, wie Virologen der Ruhr-Universität Bochum (RUB) zeigen konnten. Für eine sinnvolle Desinfektionsstrategie gegen das Coronavirus müssen jedoch einige Faktoren beachtet werden, sagt Prof. Dr. Eike Steinmann.
Um diese experimentellen Ergebnisse zu verstehen, wurden in der Arbeitsgruppe von Ludger Santen, Professor für theoretische Physik der Saar-Universität, Monte-Carlo-Simulationen durchgeführt, mit deren Hilfe die Dynamik komplexer Systeme modelliert werden kann. Das Modell beschreibt das Bakterium als starre Kugel und die Zellwandmoleküle an der Oberfläche als kleine Federchen. „Für die richtige Beschreibung der Experimente ist es entscheidender, die Zufallskomponente bei der Bindung an der Oberfläche zu betrachten, als die Komplexität des theoretischen Modells zu erhöhen. Wir haben dabei herausgefunden, warum sich die Bakterien je nach Oberfläche so unterschiedlich verhalten: Auf wasserabweisenden Materialien haften sehr viele Zellwandmoleküle, was insgesamt zu einer starken Haftung und einer gleichmäßig glatten Form der Kraft-Distanz-Kurven führt“, erläutert Ludger Santen. Auf den hydrophilen Oberflächen hingegen blieben nur wenige Moleküle hängen, die Zelle haftete folglich schlechter und die Kurvenform wurde weniger gleichmäßig. „Diese gezackte Kurvenform wird verursacht durch wenige, einzelne Zellwandmoleküle, die sich einzeln von der Oberfläche ablösen. Dadurch können die Bakterien als Ganzes schlechter an der hydrophilen Materialoberfläche anhaften“, so Erik Maikranz, der die Simulationen im Rahmen seiner Doktorarbeit durchgeführt hat.
Als Grund für die unterschiedliche Anzahl haftender Zellwandmoleküle konnten die Physiker verschiedene Wechselwirkungen und eine damit verbundene sogenannte Potentialbarriere identifizieren. „Während die Potentialbarriere auf hydrophilen Oberflächen vergleichsweise hoch ist und nur von wenigen Molekülen in einer bestimmten Zeit überwunden werden kann, ist sie auf hydrophoben Oberflächen vernachlässigbar klein, sodass sehr viele Moleküle unmittelbar anhaften können“, erklärt der promovierte Physiker Christian Spengler, der für die Experimente der Studie verantwortlich war.
Quelle: Universität des Saarlandes
17.09.2020