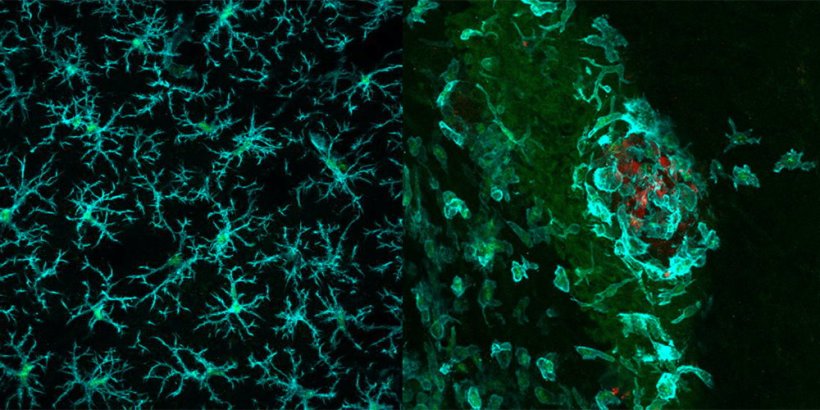
Bildquelle: Dr. Marie-Françoise Ritz, Universität Basel, Department Biomedizin, und Nicoletta Ferrari, LMU Universitätsklinikum, LMU München
News • Glioblastom-Forschung
Neuer Ansatz macht Fresszellen "taub" für Hirntumor-Signale
Glioblastome gehören zu den aggressivsten Hirntumoren. Selbst Immuntherapien, die bei anderen Krebsarten Erfolge erzielen, scheinen hier machtlos. Forschende der Universität und des Universitätsspitals Basel beschreiben nun, wie man die Chancen des Immunsystems gegen diesen Typ Tumor verbessern könnte.
"Friss mich nicht!" So könnte man das Signal übersetzen, das Krebszellen eines Glioblastoms an Immun-Fresszellen (sogenannte Makrophagen) im Gehirn senden. Immunzellen, die man im Zuge von Immuntherapien dazu befähigen möchte, die entarteten Zellen zu eliminieren. Bisher sind solche Therapien kaum erfolgreich.
Forschende um Prof. Dr. Gregor Hutter vom Departement Biomedizin der Universität und des Universitätsspitals Basel haben anhand von Patientendaten, Versuchen mit Mäusen und menschlichen Tumorproben eines dieser "Friss mich nicht!"-Signale und dessen Hemmung untersucht. In 'Science Translational Medicine' erscheinen nun ihre Ergebnisse, die den Weg für wirksame Immuntherapien gegen Glioblastome ebnen könnten.
Das Signal beruht auf Zuckermolekülen – namens Sialinsäure-Glykane – auf der Oberfläche der Krebszellen. Diese Zuckermoleküle werden wiederum von Rezeptoren auf der Oberfläche der Makrophagen des Hirns erkannt und als "Friss mich nicht!" übersetzt. Tragen die Makrophagen von Patienten besonders viele dieser Empfänger, 'Siglec9' genannt, hängt dies mit einer schlechteren Überlebensrate zusammen, berichten die Studienautoren um Hutter.
Zusammengenommen weisen unsere Ergebnisse darauf hin, dass die Sialinsäure-Siglec-Achse ein vielversprechender Angriffspunkt sein könnte
Gregor Hutter
Entfernten die Forschenden bei Versuchsmäusen gezielt mit einem genetischen Trick die Maus-Variante von Siglec9 aus den Hirn-Makrophagen, wuchsen Hirntumore bei den Tieren deutlich langsamer. Ein Hinweis darauf, dass die Fresszellen das Glioblastom teilweise in Schach halten konnten: Ihnen fehlte ja der Empfänger, um das "Friss mich nicht!"-Signal wahrzunehmen, und sie konnten ihrer Aufgabe nachgehen, entartete Zellen zu entfernen. Denselben Effekt sahen die Forschenden auch, wenn sie Tumorzellen implantierten, welche keine Zuckermoleküle auf der Oberfläche hatte.
Dies bestätigte sich auch bei Versuchen mit chirurgisch entferntem Hirngewebe von Glioblastom-Patienten, das die Forschenden im Labor kultivierten. Gaben sie einen Antikörper zum Kulturmedium, der den Empfänger Siglec9 blockierte, konnten sie eine Aktivierung der im Tumor und direkt benachbarten Gewebe vorhandenen Immunzellen feststellen.
"Zusammengenommen weisen unsere Ergebnisse darauf hin, dass die Sialinsäure-Siglec-Achse ein vielversprechender Angriffspunkt sein könnte", so Hutter. Könnte man den Empfänger der Makrophagen bei Patienten mit Antikörpern ausschalten, könnten bestehende Immuntherapien womöglich auch bei Glioblastomen ihre volle Wirkung entfalten. Ob eine lokale Gabe von Antikörpern gegen den Empfänger im Gehirn möglich ist und ob dies die gewünschte Wirkung bringt, soll in einem nächsten Schritt in klinischen Studien überprüft werden.
Quelle: Universität Basel
21.07.2023