News • Neue Einblicke in Reparaturprozesse
Wie sich der Darm nach einer Krebstherapie regeneriert
Regulatorische T-Zellen (Tregs), eine Untergruppe von Immunzellen, gelten normalerweise als „Friedenswächter“, die eine Überreaktion des Immunsystems verhindern.
© TUM
Überraschenderweise zeigt eine neue Studie, veröffentlicht in „Signal Transduction and Targeted Therapy“, dass Tregs Entzündungssignale nutzen, um nach einer Krebstherapie Reparaturprozesse zu starten. Die von der LIT-Kooperationsgruppe „Innate Immunstimulation bei Krebs und Transplantationen“ mit der Klinik und Poliklinik für RadioOnkologie und Strahlentherapie der TU München (TUM) durchgeführte Untersuchung zeigt, wie das Immunsystem verwendet werden kann, um die Darmschleimhaut zu regenerieren und das Überleben zu verbessern.
Bislang galt eine Entzündung im Darm vor allem als schädlich. „Nun haben wir gesehen, dass das Immunsystem unter bestimmten Bedingungen Entzündungssignale nutzt, um Heilungsprozesse zu starten“, fasst Prof. Hendrik Poeck, Geschäftsführender Oberarzt an der Klinik und Poliklinik für Innere Medizin III am Universitätsklinikum Regensburg (UKR) und Leiter der Kooperationsgruppe am Leibniz-Institut für Immuntherapie (LIT), die Ergebnisse zusammen. „Diese Erkenntnisse könnten wichtige klinische Implikationen für viele Patienten haben, deren Darm in Folge einer Krebsbehandlung geschädigt ist“, erklärt Erst- und Korrespondenzautor Dr. Julius Fischer, Forschungsgruppenleiter und Strahlentherapeut an der TUM School of Medicine and Health am TUM Klinikum.

© LIT; Clara Stark
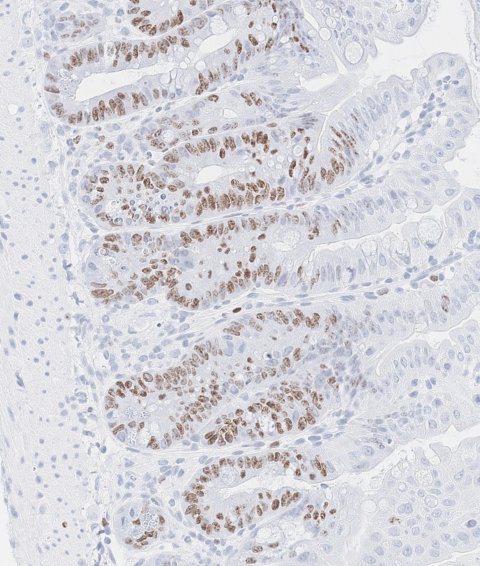
Doktorand und Erstautor Sascha Göttert von der Klinik und Poliklinik für Innere Medizin III am UKR entdeckte, dass sowohl in Mausmodellen als auch in Patientenproben Tregs zwei entzündungsassoziierte Moleküle produzieren, die gemeinsam die Darmstammzellen stimulieren: „Wir fanden heraus, dass Interferon-gamma (IFNγ) und Interleukin-10 (IL-10) zusammenwirken, um diese natürlichen Reparatureinheiten des Darms zu beeinflussen“, erklärt Göttert. Während IFNγ allein ein schnelles Zellwachstum auslöst, dabei aber den Pool der intestinalen Stammzellen erschöpft, und IL-10 allein nur eine schwache Unterstützung bietet, liefern sie gemeinsam ein starkes und zugleich dauerhaftes Reparatursignal. Diese Kombination unterstützt sowohl die schnelle Heilung als auch die langfristige Regeneration des Darms nach immun- und strahlungsbedingten Schäden, die in Folge einer Stammzelltransplantation oder Bestrahlung des Bauchraums entstanden sind.
Patienten, die intensive Krebsbehandlungen wie Strahlentherapie oder Stammzelltransplantation erhalten, leiden oft unter schweren Schäden der Darmschleimhaut. „Dies verursacht nicht nur schmerzhafte Entzündungen und Komplikationen durch Infekte, sondern verschlechtert auch langfristig die klinischen Ergebnisse“, sagt Dr. Julius Fischer. Wie die Ergebnisse der Studie zeigen, scheint das körpereigene Reparaturprogramm des Immunsystems den Darm während der Krebstherapie zu schützen: „Diese Studie hebt das Zusammenspiel von intestinalen Stammzellen mit Tregs hervor, die als eine Art Master-Reparaturzellen Immun-Signalmoleküle freisetzen und so geschädigtes Gewebe regenerieren“, konstatiert Prof. Hendrik Poeck. Das Verständnis dieser Prozesse eröffnet neue therapeutische Ansätze zur Förderung der Darmreparatur.
Erst kürzlich zeigte eine Studie von Poecks Team in „Nature Communications“, dass Darmbakterien oder ein spezifisches Stoffwechselprodukt ebenfalls intestinale Stammzellen stärken können, um Gewebeschäden in Folge einer Transplantation zu verhindern. Beide Studien zusammen markieren einen wichtigen translationalen Fortschritt in der Behandlung schwerer Nebenwirkungen von Krebs- und Transplantationstherapien – einerseits durch den gezielten Einsatz gentechnisch hergestellter Immunzellen, die bestimmte Immunmoleküle produzieren, und andererseits durch Mikrobiota-Präparate oder Ernährungsstrategien. Unter der Leitung von Wissenschaftlern des UKR und LIT werden beide Ansätze derzeit im Rahmen des Netzwerks des Nationalen Centrums für Tumorerkrankungen (NCT) für Frühphasen-Studien weiterentwickelt. Zielgruppe sind Patienten, die sich einer Transplantation oder CAR-T-Zelltherapie bei Blutkrebserkrankungen unterziehen.
Quelle: Leibniz-Institut für Immuntherapie
28.11.2025