News • Antiviralen Botenstoffe
Covid-19: Ein Immun-Mechanismus, der nach hinten losgeht
Mit antiviralen Botenstoffen will das Immunsystem SARS-CoV-2 eigentlich bekämpfen. Ein Forschungsteam der Charité – Universitätsmedizin Berlin und des Max-Delbrück-Centrums für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC) hat nun gezeigt, wie ein solcher Botenstoff die Vermehrung des Virus begünstigen kann.
Foto: Heuberger/Charité
Die Ergebnisse wurden jetzt im Fachjournal EMBO Molecular Medicine veröffentlicht.
Die meisten Menschen, die SARS-CoV-2 infiziert, können die Erkrankung zu Hause auskurieren – auch wenn es bei ihnen sehr belastende Krankheitsverläufe gibt. Ein Teil hat gar keine Symptome. Doch etwa zehn Prozent der Betroffenen sind so schwer erkrankt, dass sie im Krankenhaus behandelt werden müssen. Die Annahme, dass hinter einem schweren Verlauf ein schwaches Immunsystem steckt, greift zu kurz. Denn gerade bei kritischen Verläufen arbeitet das Immunsystem unter Hochdruck, schafft es aber nicht, das Virus zu kontrollieren.
Eine Berliner Forschungsgruppe konnte nun beobachten, wie SARS-CoV-2 einen Verteidigungsmechanismus des Immunsystems nutzt, um verstärkt Schleimhautzellen des Körpers zu entern und sich dort zu vermehren. „Damit können wir möglicherweise einen Teil der Erklärung dafür liefern, warum bei manchen Menschen das Immunsystem Schwierigkeiten hat, die Infektion zu regulieren oder gar zu besiegen“, sagt Dr. Julian Heuberger, Wissenschaftler an der Medizinischen Klinik mit Schwerpunkt Hepatologie und Gastroenterologie der Charité. Er ist Erstautor der Studie und Mitglied der Emmy-Noether-Arbeitsgruppe von Privatdozent Dr. Michael Sigal an der Charité und dem Berliner Institut für Medizinische Systembiologie (BIMSB), das zum MDC gehört. Für die Untersuchung kooperierte die Arbeitsgruppe mit Forschenden des Max-Planck-Instituts für Infektionsbiologie, der Freien Universität Berlin und der Universität Hongkong.
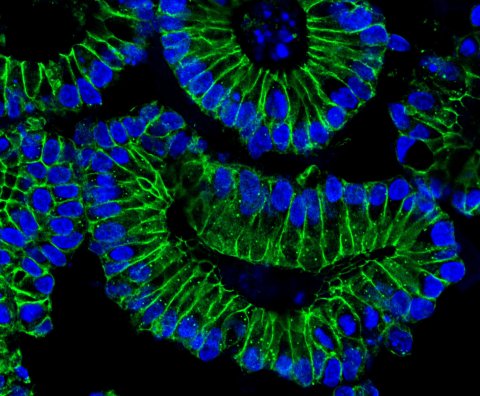
Foto: Heuberger/Charité
Eigentlich läuft im menschlichen Körper ein sehr effektives Verteidigungsprogramm gegen Eindringlinge ab, das auf dem Zusammenspiel verschiedener Immunzellen basiert. Eine wichtige Rolle spielen dabei die T-Zellen: Stoßen Sie im Organismus auf Viren, zerstören sie die befallenen Zellen. Außerdem schütten sie den Botenstoff Interferon-gamma (IFN-γ) aus. IFN-γ bekämpft einerseits Infektionskeime. Andererseits ruft es weitere Immunzellen auf den Plan.
Dr. Heuberger und seine Mitstreiter haben nun gezeigt, wie SARS-CoV-2 diesen IFN-γ-vermittelten Schutzmechanismus in sein Gegenteil verkehren kann. Denn neben den Immunzellen reagieren auch die Schleimhautzellen (Epithelzellen) des Körpers auf IFN-γ, indem sie mehr ACE2-Rezeptoren ausbilden. SARS-CoV-2 benötigt diese ACE2-Rezeptoren als Einstiegspforte in die Zellen. Infizierte Zellen wiederum bilden mehr ACE2. Sowohl die IFN-γ-Antwort der Epithelzellen als auch das Virus selbst bewirken also eine verstärkte SARS-CoV-2-Infektion.
SARS-CoV-2-infizierte Patienten zeigen teilweise gastrointestinale Beschwerden. Um die Immunkaskade in den Darmzellen beobachten zu können, hat Dr. Heuberger Organoide des menschlichen Dickdarms kultiviert. Ein Organoid ist eine Art Mini-Organ in der Petrischale, kaum so groß wie ein Stecknadelkopf. Die Dickdarm-Organoide basieren auf Zellen, die aus Darmbiopsien stammen. Sie wachsen in dreidimensional angeordneten Einheiten und bilden die Physiologie der Schleimhautzellen des menschlichen Darmtraktes ab. „Diese Dickdarm-Organoide sind ein sehr hilfreiches Werkzeug“, unterstreicht Dr. Heuberger, „wir können damit das komplexe Zusammenspiel verschiedener Signalwege erforschen, die die Zelldifferenzierung von der Stammzelle bis zur spezialisierten Epithelzelle kontrollieren.“
Dieser Artikel könnte Sie auch interessieren
News • Antivirales Potenzial von Remdesivir & Co.
Forscher untersuchen Covid-Medikamente im "Mini-Darm"
Zu Beginn der Coronavirus-Pandemie galt Covid-19 als reine Atemwegserkrankung mit Symptomen von Husten bis zur Lungenentzündung. Doch mittlerweile sind ganz andere Krankheitszeichen bekannt, darunter Übelkeit und Durchfall. Solche Auswirkungen auf den Magen-Darmtrakt weisen sogar auf einen schweren Verlauf hin.
Wenn die IFN-γ-Konzentration von vornherein höher ist oder die Infektion eine sehr überschießende Produktion von IFN-γ triggert, haben es die Viren vermutlich leichter, in die Zellen einzudringen
Michael Sigal
Die Wissenschaftler behandelten die gezüchteten Darmzellen zunächst mit IFN-γ, um die Immunreaktion des Körpers zu simulieren. Dann infizierten sie die Organoide mit SARS-CoV-2. Mithilfe eines Laser-Scanning-Mikroskops und Genexpressionsanalysen konnten sie in den Organoiden eine vermehrte ACE2-Expression messen. Daneben wies eine quantitative PCR eine gesteigerte Virusproduktion nach. Das heißt: Mehr IFN-γ bedeutet mehr ACE2. Mehr ACE2 bedeutet, dass mehr Viren in die Zellen eindringen können. Je mehr Viren in die Zellen gelangen, umso mehr Viren werden gebildet. So ebnen die Immunantwort und die Reaktion der Schleimhautzellen auf die Infektion SARS-CoV-2 den Weg.
„Wir nehmen an, dass eine starke Immunantwort die Anfälligkeit von Schleimhautzellen für SARS-CoV-2 erhöhen kann“, sagt der Leiter der Studie Privatdozent Dr. Sigal. Er leitet an der Charité und am MDC eine Arbeitsgruppe und ist als Gastroenterologe an der Charité tätig. „Wenn die IFN-γ-Konzentration von vornherein höher ist oder die Infektion eine sehr überschießende Produktion von IFN-γ triggert, haben es die Viren vermutlich leichter, in die Zellen einzudringen.“ Unter welchen Bedingungen das tatsächlich passiert, muss allerdings erst in klinischen Studien untersucht werden. Die Ergebnisse der Studie tragen die Idee eines Behandlungsansatzes bei schweren COVID-19-Verläufen in sich, sagt Dr. Heuberger: „Eine mögliche Strategie könnte darin bestehen, die IFN-γ-Antwort medikamentös auszubalancieren.“ Allerdings müssten dafür zunächst die Mechanismen, die der IFN-γ-Antwort zugrunde liegen, sehr genau analysiert werden.
Quelle: Charité – Universitätsmedizin Berlin
16.02.2021