News • Anämieforschung
Blutarmut: Wenn die Zelle zu wenig Proteinfabriken herstellt
Neue Einsichten in die Entstehung von Blutzellen
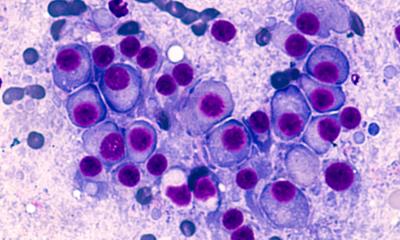
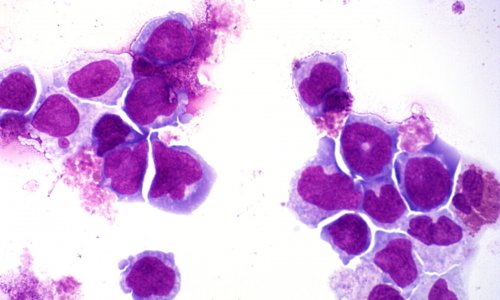
Jeden Tag bildet der Körper aus den Stammzellen des Knochenmarks Milliarden neuer roter Blutkörperchen. Ist dieser Prozess gestört, kann eine ernsthafte Erkrankung die Folge sein. Forscher der Charité – Universitätsmedizin Berlin und der Harvard Medical School haben nun das Verständnis für die Bildung der Blutzellen erweitert. Die Einsichten in die molekularbiologischen Grundlagen können wegweisend für die Therapie bestimmter Krankheitsformen der Blutarmut sein. Veröffentlicht wurden die Ergebnisse der Studie jetzt in der Fachzeitschrift Cell.
Selbst bei einem inzwischen gut verstandenen Prozess wie der Blutbildung gibt es einige Aspekte, die wissenschaftlich nicht voll erforscht sind. So wird zum Beispiel noch nicht gänzlich verstanden, wie die Produktionsmenge der sogenannten Transkriptionsfaktoren reguliert wird. Diese speziellen Proteine steuern die Entwicklung von Blutstammzellen in die unterschiedlichen Zelllinien des Blutes. Ein geeignetes Modell für ihre Erforschung ist die Diamond-Blackfan-Anämie (DBA). Bei dieser Erbkrankheit haben die Patienten einen Defekt in der Entwicklung der roten Blutkörperchen, während sich die anderen Blutzelllinien normal entwickeln.
Eine solche Therapie wäre zugänglich für sämtliche DBA-Patienten, unabhängig von deren zu Grunde liegender Mutation
Rajiv K. Khajuria
Rajiv K. Khajuria, Doktorand der Berlin-Brandenburg School for Regenerative Therapies der Charité, und die Arbeitsgruppe von Prof. Vijay G. Sankaran vom Boston Children's Hospital der Harvard Medical School und dem Broad Institute haben die Entwicklung von der Stammzelle zur Blutzelle auf molekularer Ebene untersucht. Sie konnten zeigen, dass die gestörte Bildung roter Blutkörperchen bei DBA auf einer verringerten Anzahl von Ribosomen, den sogenannten Proteinfabriken der Zelle, beruht. Charakteristisch für die DBA sind Mutationen in einem der Proteine, aus denen die Ribosomen selbst aufgebaut sind. Diese Mutation verringert zwar die Zahl der Proteinfabriken, aber nicht ihre Zusammensetzung. Außerdem stellte sich heraus, dass bei diesen Ribosomen die Umsetzung bestimmter Erbinformation in neue Proteine beeinträchtigt ist. Betroffen war hierbei der für die Bildung roter Blutkörperchen wichtige Transkriptionsfaktor GATA1 und das bereits auf der Ebene der Blutstammzellen. Die für die Produktion des Transkriptionsfaktors benötigte Abschrift der Erbinformation, die sogenannte Boten-RNA, zeigt eine strukturelle Besonderheit, die dieses Molekül möglicherweise bei verringerter Ribosomen-Anzahl bei DBA anfällig macht. Die spezielle Struktur der Boten-RNA von GATA1 könnte erklären, warum sich bei DBA alle anderen Blutzelllinien völlig normal aus den Stammzellen heraus entwickeln.
Auf der Ebene der Grundlagenforschung bietet die Studie eine Antwort auf die fundamentale Frage der Biologie, wie die Entwicklung von Zelllinien reguliert wird, nachdem die ursprüngliche Erbinformation in Boten-RNAs übersetzt wurde. Demnach steuert die Zahl der Ribosomen in einer Zelle in Wechselwirkung mit bestimmten Strukturelementen der Boten-RNAs die Richtung, in die sich eine Stammzelle entwickelt. Darüber hinaus kann das verbesserte Verständnis der Entstehung der Diamond-Blackfan-Anämie die Basis einer Entwicklung neuer Therapien für Patienten mit dieser Krankheit sein. „Derzeit entwickelt die Arbeitsgruppe ein therapeutisches Verfahren, das gezielt am Transkriptionsfaktor GATA1 ansetzt. Eine solche Therapie wäre zugänglich für sämtliche DBA-Patienten, unabhängig von deren zu Grunde liegender Mutation“ beschreibt Khajuria das Ziel der aktuellen Forschung.
Quelle: Charité – Universitätsmedizin Berlin
16.03.2018