Illustration: Jonas Fernbach
News • Wunderwaffe gegen Bakterien
Synthetische Phagen mit programmierbarer Spezifität
ETH-Forscher haben Wege gefunden, Bakteriophagen so zu programmieren, dass sie nebst ihrem üblichen Wirt auch andere Mikroorganismen erkennen und abtöten können. Damit ebnen die Forscher den Weg für den therapeutischen Einsatz standardisierter Phagen.
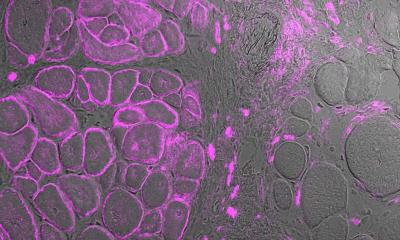
Bakteriophagen (oder kurz: Phagen) werden als potenzielle Wunderwaffe gegen krankmachende Bakterien gehandelt, insbesondere solche, die gegen jegliche Antibiotika resistent geworden sind. Phagen sind Viren, die Bakterien befallen, wobei sie höchst wirtsspezifisch sind, also nur einzelne Bakterienarten oder sogar Unterarten präzise erkennen und effizient abtöten können – ohne Kollateralschäden in der übrigen Bakterienflora anzurichten, wie dies Antibiotika oft tun.
Diese hohe Spezifität hat aber auch einen Nachteil: Um Phagen für Therapien verwenden zu können, mussten sie bis anhin aus der natürlichen Umwelt isoliert und charakterisiert werden. Das ist zeit- und arbeitsintensiv. Und um halbwegs sicher zu gehen, dass der richtige dabei ist, mussten Kliniker verschiedene Phagentypen aufs Mal verabreichen. Solche Therapien sind allerdings kaum standardisierbar.
Unter der Leitung von Samuel Kilcher, Träger eines SNF Ambizione Grants, haben Forschende am Institut für Lebensmittel, Ernährung und Gesundheit (IFNH) der ETH Zürich nun bestimmte Phagen genetisch so umprogrammiert, dass deren Nachkommen auch andere Wirte als ihren üblichen erkennen und attackieren können.
Phagen binden ihre Wirte mittels sogenannter Rezeptorbindeproteine, welche das Zielbakterium nach dem Schlüssel-Schloss-Prinzip erkennen. "Mithilfe der Röntgenkristallographie haben wir die erste atomare Struktur des Rezeptorbindeproteins eines Listeriaphagen gelöst", sagt der Erstautor Matthew Dunne.
Anhand dieser Information entwarfen die Forscher dann neue Rezeptorbindeproteine mit unterschiedlicher Wirtsspezifität, welche nach dem Legoprinzip aus verschiedenen Proteinbestandteilen zusammengebaut werden können. Listeriaphagen wurden letztlich genetisch so modifiziert, dass sie solche Designer-Rezeptorbindeproteine kodieren und daher neue Stämme des Zielbakteriums erkennen, infizieren und töten. Obwohl diese verschiedenen Designerphagen neue Wirte attackieren, teilen sie ein und dasselbe strukturelle "Gerüst".
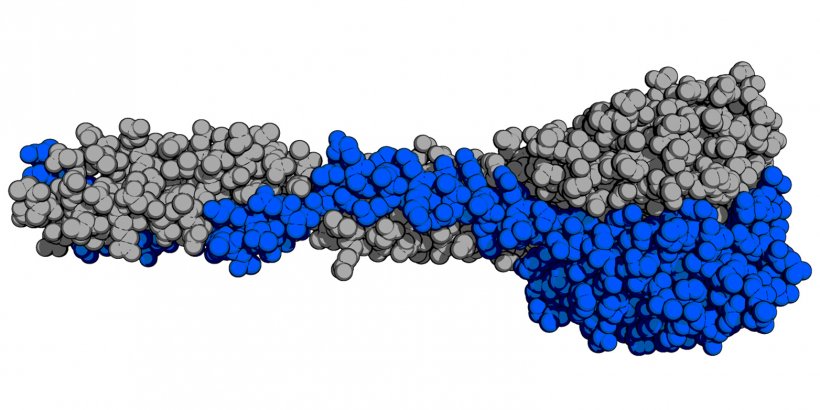
Illustration: M. Dunne/ETH Zürich
Ein Phagencocktail als Therapieform
Für eine Therapie könnte nun ein Mix solcher Phagenvarianten verwendet werden. "Einen breiten Wirtsbereich können wir abdecken, wenn wir mehrere synthetisch erzeugte Phagen in einem einzigen Cocktail verabreichen würden", erklärt Kilcher. Der Unterschied zu einem Wildtyp-Phagencocktail sei, dass die synthetischen viel gezielter entwickelt, hergestellt und angepasst werden könnten. Die künstlichen Phagen in Reinkultur zu züchten, ist weder teuer noch aufwändig. "Wir können sie für fast jeden Einsatzzweck entsprechend programmieren."
Nebst therapeutischen Anwendungen könnten die Forschenden die synthetischen Phagen z.B. auch als diagnostische Marker von spezifischen molekularen Strukturen einsetzen, etwa um in einer gemischten Bakterienpopulation genau einen Stamm zu identifizieren.
Bis eine Therapie mit genetisch modifizierten Phagen in die Klinik kommt, sind noch viele Hürden zu nehmen. Die vorliegende Studie ist erst ein Machbarkeitsnachweis. Sie bezieht sich auf das Modellsystem Listeria. Dieses Bakterium kommt in Lebensmitteln vor und kann bei immunschwachen Menschen schwere Infektionen hervorrufen.
Die Forscher planen nun, künstliche Phagen gegen andere Krankheitserreger zu erzeugen, bei welchen die herkömmliche Therapie aufgrund von Antibiotikaresistenz oft schwierig ist. Dazu gehören beispielsweise Staphylococcus aureus, Klebsiella pneumoniae, Pseudomonas aeruginosa und Enterobacter. Die Methoden zur Herstellung solcher Phagen im Labor müssen jedoch erst noch entwickelt werden. «Jeder Phage und jeder Wirtsorganismus bergen besondere Herausforderungen», betont ETH-Professor Martin Loessner, Studienkoautor und Leiter des Labors für Lebensmittelmikrobiologie am IFNH. Er denkt aber, dass es nur eine Frage der Zeit ist, bis auch eine Werkbank für solche Erreger entwickelt wird.
Auf Phagentherapien ruhen viele Hoffnungen. In einem Fall wurden genetisch modifizierte Phagen bereits heute therapeutisch eingesetzt. So berichteten amerikanische Forschende vor wenigen Monaten in der Fachzeitschrift «Nature Medicine» über einen Fall, bei dem einer 15-Jährigen, die an cystischer Fibrose leidet, Phagen verabreicht wurden, um eine schwere, von Mycobakterien verursachte Infektion zu heilen. Das gelang. Noch aber fehlen breit angelegte klinische Studien, die für die Zulassung von Phagentherapien notwendig sind.
Quelle: ETH Zürich
05.11.2019