Stillgelegte Gene als Warnhinweis für Blutkrebs
Im Erbgut von Krebszellen sind wichtige Wachstumsbremsen oft durch chemische Markierungen der DNA stillgelegt. Wie es dazu kommt, untersuchten Wissenschaftler aus dem Deutschen Krebsforschungszentrum gemeinsam mit Kollegen von der amerikanischen Ohio State University.

Sie entdeckten, dass bei Mäusen die krebstypischen Erbgut-Markierungen lange vor den ersten Symptomen einer Blutkrebs-Erkrankung auftreten. Ein Test auf die Genmarkierung könnte daher eine entstehende Krebserkrankung frühzeitig aufspüren.
Bei vielen Krebserkrankungen sind Teile des Erbguts der Tumorzellen durch chemische Markierungen, so genannte Methylgruppen, stillgelegt. Die Methyl-Markierung zählt zu den epigenetischen Veränderungen, die nicht die Reihenfolge der DNA-Bausteine verändern. Besonders häufig betroffen sind ausgerechnet solche Gene, die als wichtige Bremsen des krankhaften Zellwachstums wirken.
Krebsforscher wissen nicht, warum sich gesunde und Krebszellen im Methylmuster unterscheiden und warum gerade die Krebsbremsen so häufig ausgeschaltet werden. Diese Fragen gelten als vielversprechendes Forschungsfeld, da Medikamente zur Verfügung stehen, die das Anheften der Methylgruppen oder auch andere epigenetische Veränderungen verhindern und damit die Krebsentstehung zumindest hinauszögern können.
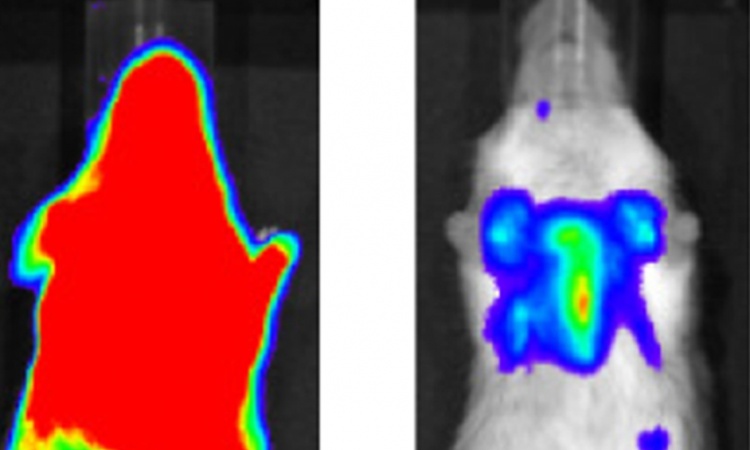
Professor Dr. Christoph Plass im Deutschen Krebsforschungszentrum untersuchte gemeinsam mit Kollegen von der Universität in Columbus, USA, wie es zu den abweichenden Methylmarkierungen in Krebszellen kommt. Dabei ist eine zentrale Frage, wann im Verlaufe der Krebsentstehung erste Markierungen auftreten. Als Untersuchungsmodell für ihre gerade veröffentlichte Studie wählten die Wissenschaftler Mäuse, die an chronisch-lymphatischer Leukämie erkranken.
Die Forscher untersuchten das Erbgut der Leukämie-Mäuse von Geburt an in regelmäßigen Abständen. Erste krebstypische Methylmuster entdeckten sie bereits bei drei Monate alten Mäusen. Die abweichende Methylierung tritt damit weit vor den ersten Anzeichen der Erkrankung auf, die erst bei dreizehn Monate alten Tieren beobachtet werden. Darüber hinaus konnten die Forscher zeigen, dass die Methylmuster im Mäuse-Erbgut weitgehend übereinstimmen mit denen, die auch bei leukämiekranken Menschen gefunden werden. Das bestätigt, dass sich die Leukämie-Mäuse als Untersuchungsmodell für die Erkrankung eignen.
"Da bei Mäusen so früh schon erste abweichende Methylierungen auftreten, sollten wir prüfen, ob das auch für Menschen gilt. Dann könnte ein frühzeitiger Methylierungs-Test bei Risikopersonen Hinweise auf das Entstehen einer Krebserkrankung geben", sagt Christoph Plass. In diesem Fall könnten die Ärzte möglicherweise präventiv eingreifen: Medikamente, die die Methylanheftung verhindern, könnten die Krebsentstehung verzögern. Erste klinische Studien dazu laufen bereits. "Das ist wahrscheinlich in einer ganz frühen Phase der Methylierung am sinnvollsten", erklärt Plass. Denn die ersten chemisch stillgelegten Gene lösen nach Meinung der Forscher ganze Kaskaden an Erbgutveränderungen aus, die später nur noch schwer in den Griff zu bekommen sind.
Stichwort Epigenetik:
Die Zellen der rund 200 verschiedenen Gewebe des menschlichen Organismus können ihre speziellen Aufgaben nur dann erfüllen, wenn sie die Aktivität ihrer jeweils benötigten Gene ganz spezifisch steuern. Zwar ist jedes einzelne Gen mit eigenen Schaltelementen versehen, doch dies reicht für die komplexe Koordination nicht aus. Ein zweiter Code dient als zusätzliche
Steuerungsebene: Neben den Genschaltern, die direkt ins Erbmolekül DNA eingebaut sind, können Gene zusätzlich durch chemische Markierung der DNA oder der DNA-Verpackungsproteine an- und abgeschaltet werden. Die häufigste dieser so genannten epigenetischen Mutationen ist das Anheften von Methylgruppen. Diese kleinen chemischen Verbindungen bewirken, dass ein Gen nicht mehr abgelesen und in Proteine übersetzt werden kann.
Im Gegensatz zu Genmutationen, die die Abfolge der Erbgutbausteine endgültig verändern, sind alle epigenetischen Mutationen reversibel und daher potenzielle Zielstrukturen für entsprechende Medikamente.
Shih-Shih Chen, Aparna Raval, Amy J. Johnson, Erin Hertlein, Te-Hui Liu, Victor X. Jin, Mara Sherman, Shu-Jun Liu, David W. Dawson, Katie E. Williams, Mark Lanasa, Sandya Liyanarachchi, Thomas S. Lin, Guido Marcucci, Yuri Pekarsky, Ramana Davuluri, Carlo M. Croce, Denis C. Guttridge, Michael A. Teitell, John C. Byrd,, and Christoph Plass: Epigenetic changes during disease progression in a murine model of human chronic lymphocytic leukemia.
Proceedings of the National Academy of Science, USA, 2009,
DOI: 10.1073/pnas.0906455106
05.08.2009