© EPFL
News • Im Fokus
Scharf gestellt: Algorithmus optimiert Super-Mikroskope
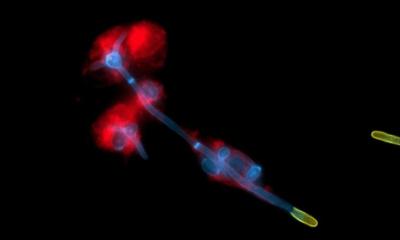
Forscher der Eidgenössischen Technischen Hochschule Lausanne (EPFL) haben einen Algorithmus entwickelt, der anhand nur eines Bildes beurteilen kann, ob ein super-auflösendes Mikroskop wirklich mit höchster Auflösung arbeitet.
Damit wird es leichter, die Geräteeinstellungen gegebenenfalls nachzuoptimieren. Der in einer Studie in "Nature Methods" vorgestellte Algorithmus könnte gerade für die zunehmend aufkommenden automatisierten Mikroskope interessant sein. Super-auflösende Mikroskope, die sich die Fluoreszenz mancher Substanzen zunutze machen, sind für Wissenschaftler unentbehrlich. Denn sie erlauben es, Strukturen in Zellen, Proteinen und lebendem Gewebe mit unglaublicher Genauigkeit zu beobachten. Die Bildqualität hängt dabei jedoch stark vom Gerät, seinen Einstellungen und der jeweiligen Probe ab. Um zu prüfen, mit welcher Auflösung ein Mikroskop tatsächlich arbeitet, waren bislang zwei Bilder nötig und die Ergebnisse dennoch mit relativ großen Unsicherheiten behaftet.
Unsere Technik ist besonders vielversprechend für die aufkommende Generation automatisierter Mikroskope, bei denen ein Computer alle Einstellungen anpasst
Aleksandra Radenovic
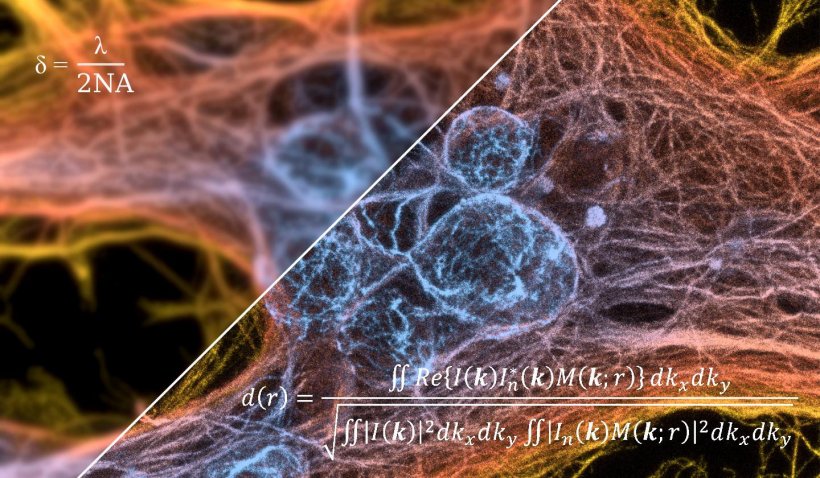
Der neue Algorithmus kann nun innerhalb weniger Sekunden quasi auf einen Blick klar beurteilen, bei welcher Auflösung ein Mikroskop arbeitet und ob es sein Potenzial somit voll ausschöpft. Basis für den Algorithmus ist dabei eine modifizierte Fouriertransformation, die möglichst viel Info aus dem einen Bild extrahiert. Das liefert in wenigen Sekunden eine einfache Zahl. "Die können Forscher mit der Maximalauflösung des Mikroskops vergleichen, um zu sehen, ob das Gerät noch besser arbeiten könnte", sagt Studien-Erstautor Adrien Descloux. Falls nicht, können sie bei den Einstellungen nachbessern.
"Unsere Technik ist besonders vielversprechend für die aufkommende Generation automatisierter Mikroskope, bei denen ein Computer alle Einstellungen anpasst", sagt Aleksandra Radenovic, Leiterin des Laboratory of Nanoscale Biology an der EPFL. Denn wie Descloux betont, ist der Algorithmus universell anwendbar. Da er nur ein Bild benötigt, erlaubt er eine schnelle Optimierung der Aufnahmebedingungen, was gerade für dynamische Vorgänge, beispielsweise in Zellen, wichtig ist.
Damit der Algorithmus breit zur Anwendung kommen kann, stellt ihn das EPF-Team als quelloffenes Plug-in bereit: http://github.com/Ades91/ImDecorr
Quelle: EPFL/pressetext
29.08.2019