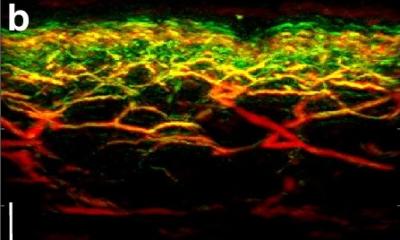
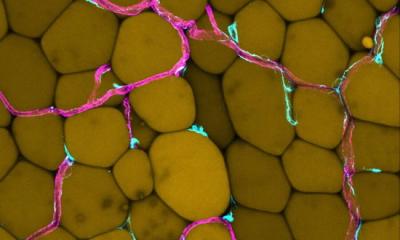
Quelle: Felix Heyder/Herzzentrum UKB
News • Arteriosklerose
Protein beeinflusst Regeneration von Gefäßzellen
Mediziner des Herzzentrums des Universitätsklinikums Bonn haben mit ihrer Grundlagenforschung herausgefunden, wie sich die Kommunikation zwischen einzelnen Zellen mithilfe eines Proteins beeinflussen lässt. Die Ergebnisse sind ein wichtiger Ansatz, um Krankheiten wie die Herzinfarkt auslösende Arteriosklerose (verkalkte Gefäße) perspektivisch besser therapieren zu können.
Der menschliche Körper besteht aus einer unvorstellbar großen Zahl von Zellen. Aktuelle wissenschaftliche Untersuchungen gehen je nach Gewicht und Größe des Menschen von rund 40 Billionen Zellen aus. Um ihre Funktion im Körper bestmöglich zu erfüllen, schließen sich die allermeisten Zellen zusammen. Gemeinsam bilden sie unter anderem Gewebe, Organe und Muskeln. Die wichtigste Voraussetzung für ein gutes Zusammenspiel der Zellen ist eine möglichst effektive Kommunikation untereinander.
„Damit Zellen wirksam miteinander kommunizieren können, benötigen sie einen Postboten, der Informationen von einer Zelle zur nächsten transportiert“, erklärt Dr. Andreas Zietzer, Kardiologe am Herzzentrum des Universitätsklinikums Bonn. „Genau diese Funktion übernehmen sogenannte extrazelluläre Vesikel.“ Lange Zeit wurde diesen Vesikeln nur geringe biologische Bedeutung beigemessen. Man vermutete, dass Zellen die Vesikel lediglich nutzen, um sich überflüssiger Proteine und anderer Moleküle zu entledigen, sie also eine Art zelluläre Müllabfuhr sind. Mittlerweile weiß man jedoch, dass Vesikel ganz maßgeblich für die interzelluläre Kommunikation verantwortlich sind.
Vesikel dienen als Postboten zwischen den Zellen
Das Prinzip der Vesikel lässt sich einfach erklären: Sie werden als äußerst kleine – nur etwa ein zweitausendstel Millimeter große – Membranbläschen von Zellen unseres Körpers ausgeschüttet und können von anderen Zellen wiederaufgenommen und verwertet werden. Zietzer beschreibt die entscheidende Funktion der Vesikel: „Als Postbote transportieren sie verschiedene Inhalte und ermöglichen so den Informationsaustausch zwischen den Zellen.“
Neben Proteinen und Lipiden werden bei diesem Kommunikationsprozess auch Nukleinsäuren (RNAs) verschickt. Diese RNAs sind Kopien der Erbinformation und werden für die Ausführung der Geninformation benötigt. Die Mediziner der Universität Bonn richteten den Fokus ihrer Forschung vor allem auf sogenannte microRNAs, die die Feinjustierung bei der Ein- und Ausschaltung von Genen übernehmen.
„Da microRNAs großen Einfluss auf die Biologie der Zellen haben, können Vesikel in Abhängigkeit ihrer spezifischen Fracht die Empfängerzellen funktionell beeinflussen“, sagt Zietzer. Denn je nachdem, welche microRNA in den Vesikeln angereichert wird, ändern sich auch die Informationen, die von den Vesikeln transportiert werden und damit auch der Effekt auf die Empfängerzellen, die die Vesikel und ihre Fracht aufnehmen. „Für Wissenschaftler und Mediziner wäre es ein Durchbruch, wenn sie steuern könnten, welche Informationen zwischen den Zellen transportiert werden und welche nicht“, blickt Zietzer in die Zukunft. „Genau dieses Eingreifen in die Zell-zu-Zell-Kommunikation ist bislang jedoch kaum untersucht worden.“
Die Arbeitsgruppe um Zietzer, Dr. Rabiul Hosen und Privatdozent Dr. Felix Jansen (Leiter der Arbeitsgruppe) vom Herzzentrum des Universitätsklinikums Bonn konnte nun an menschlichen Zellen einen neuen Mechanismus aufklären, wie das Sortieren von bestimmten RNAs innerhalb der Vesikel funktioniert. Dazu untersuchten die Wissenschaftler unter anderem mithilfe eines Massenspektrometers über 3.000 Proteine und mehr als 300 microRNAs, die schon in Vesikel eingeschlossen und bereit für den Transport zu anderen Zellen waren.
Ein RNA-bindendes Protein hält die Post zurück
Dabei konnten die drei Forscher zeigen, dass ein bestimmtes RNA-bindendes Protein (kurz „hnRNPU“) die microRNAs in der abgebenden Zelle wie ein Schwamm zurückhält und auf diese Weise dafür sorgt, dass sie nicht in Vesikel verpackt und zu einer anderen Zelle transportiert werden können. Genau umgekehrt verhält es sich, wenn dieses spezielle Protein ausgeschaltet wird: In diesem Fall kommt es zu einer erhöhten Freisetzung der microRNAs, die dann vermehrt in die Vesikel verpackt werden.
„Das RNA-bindende Protein hnRNPU übernimmt somit die Rolle eines Gatekeepers, der entscheidet, welche und wie viele microRNAs von der Senderzelle für den Transport zur Empfängerzelle freigegeben werden und welche nicht“, fasst Andreas Zietzer die Forschungsergebnisse zusammen. Durch diese Funktion kann das Protein hnRNPU die Kommunikation zwischen den Zellen ganz wesentlich beeinflussen.
Die Beobachtungen bergen ein großes therapeutisches Potential: So konnten Zietzer, Hosen und Jansen zeigen, dass sich durch Steigerung oder Reduktion der hnRNPU-Menge in den abgebenden Zellen der Transfer bestimmter microRNAs über die Vesikel steuern lässt. „Auf diese Weise können microRNAs, die eine Regeneration fördern, gezielt freigesetzt oder zurückgehalten werden und so die Regenerationsfähigkeit von kranken Gefäßzellen positiv oder negativ beeinflussen“, kommentiert Zietzer den Eingriff in die Zellkommunikation. Dies ist medizinisch von entscheidender Bedeutung, da die Regenerationsfähigkeit der Gefäßzellen bei kranken und verkalkten Gefäßen (Arteriosklerose) bereits im Frühstadium eingeschränkt ist.
Ihre Erkenntnisse über die interzelluläre Kommunikation mittels extrazellulärer Vesikel wollen Zietzer, Hosen und Jansen nun nutzen: „So ist es denkbar, durch gezieltes lokales Ein- und Ausschalten des Proteins hnRNPU in gesunden Teilen des Gefäßsystems einen `Schwarm´ von regenerations-fördernden Vesikeln abzuschicken, die anschließend von bereits geschädigten Gefäßarealen aufgenommen werden und dort die Regeneration beschleunigen könnten. Dies könnte in kritischen Situationen – beispielsweise nach einem Herzinfarkt – den Heilungsprozess der Patienten fördern“, so Zietzer über den konkreten Nutzen dieser Grundlagenforschung.
Weitere Studien zur Anwendbarkeit befinden sich derzeit in der Durchführung. Aktuelle Forschungsergebnisse lassen darauf schließen, dass dieser Mechanismus insbesondere auch beim Zusammenspiel von Herz- und Nierenerkrankungen von großer Relevanz ist.
Die Studie wurde online im „Journal of Extracellular Vesicles“ veröffentlicht.
Quelle: Rheinische Friedrich-Wilhelms-Universität Bonn
20.08.2020