Patrick Doll, KIT
News • Hightech-Zahnersatz
Mit Nanotechnik gegen Bakterien
ikrotechnik wird für die Medizintechnik immer wichtiger, auch in der Implantologie öffnet sie neue Potenziale. Wissenschaftler haben nun eine nanostrukturierte Oberfläche entwickelt, welche die Wundheilung nach der Implantation künftig beschleunigen und besser gegen den Einfall von Bakterien schützen kann.
Gefäßerweiternde Stents, „Labs-on-Chip“ für Analysen auf kleinster Fläche, 3-D-Zellkultursysteme für die Geweberekonstruktion: Mikrotechnik wird für die Medizintechnik immer wichtiger. Auch in der Implantologie öffnet sie neue Potenziale. Wissenschaftler des Karlsruher Instituts für Technologie (KIT) haben gemeinsam mit Experten für Zahnimplantate eine nanostrukturierte Oberfläche entwickelt, welche die Wundheilung nach der Implantation künftig beschleunigen und besser gegen den Einfall von Bakterien schützen kann.
„Mikrotechnik kann Zahnimplantate nachhaltig verbessern“, sagen Professor Andreas Guber und Dr. Ralf Ahrens, die am Institut für Mikrostrukturtechnik (IMT) des KIT die Forschungsgruppe „Biomedizinische Mikrotechnik“ (BioMEMS) leiten. Moderne Zahnimplantate bestehen aus einer Titan-Schraube, die als Wurzelersatz in den Kieferknochen eingebracht wird, einem damit verbundenen „Stützpfeiler“ – auch „Abutment“ genannt – aus Titan für den Zahnersatz und der sichtbaren Zahnkrone. Titan ist das Material der Wahl. Es ist biokompatibel und sorgt für ein gutes Einwachsen der Schraube in den Knochen, die so genannte Osseointegration. Optimierungen von Zahnimplantaten fokussierten sich bislang vor allem auf die Titanoberfläche der Schraube, um diesen Prozess weiter zu verbessern. Problematisch ist aber, dass Zahnimplantate sich auch nach erfolgreicher Osseointegration entzünden können.
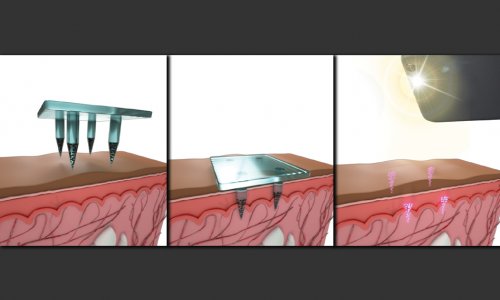
Haupteinfallstor für Bakterien ist das Abutment. An diesem Implantteil wächst das Zahnfleisch häufig nicht richtig an. Dadurch können sich Taschen bilden, über die Bakterien bis zum Kieferknochen gelangen und dort Entzündungen hervorrufen können. In diesem Fall bleibt in der Regel nur die Entfernung des gesamten Implantats. Diese potentielle Problemstelle will das BioMEMS-Team schließen. Die Forschungen basieren auf einer beim Implantat-Spezialisten „Abutments4life“ entwickelten Optimierung: Kaum haarbreite Rillen umlaufen das Abutment und steuern die für die Wundheilung zuständigen Zellen gezielt in die richtige Richtung. So kann die Wunde schneller verheilen. „An diesem System setzen wir an“, berichtet Patrick Doll, Wissenschaftler am IMT. Bei der Weiterentwicklung stehen zwei Dinge im Fokus. Zum einen eine präzisere Strukturierung der Rillen für eine noch genauere Steuerung der Zellen und zum anderen die Suche nach der optimalen Nanooberfläche, die den Bakterien möglichst wenige Chancen zum Andocken bietet.
„Wir glauben, dass unser struktureller Ansatz zukunftsweisend ist.“
Patrick Doll
Mit dem Elektronenstrahlschreiber hat Doll säulenförmige Strukturen mit einem Durchmesser von 100 Nanometern und einer Höhe von 500 Nanometern hergestellt, hieran Adhäsionsexperimente mit typischen Testkeimen wie S. Aureus, E coli oder P. aeruginosa durchgeführt und die Strukturen dabei immer wieder verändert. Dabei zeigte sich: Abhängig von Abstand und Anordnung der Säulen reduziert sich die Anhaftung der Bakterien und die Bildung eines Biofilmes verzögert sich. Den nachwachsenden Zellen bleibt dadurch mehr Zeit, um die Wunde zu verschließen – ein Effekt, den ansonsten nur Antibiotika erzielen.
„Wir glauben, dass unser struktureller Ansatz zukunftsweisend ist“, betont Doll. Die Herstellung der Nano-Strukturen gelingt auf Silizium-Basis fehlerfrei und reproduzierbar. Verfahren für die Übertragung auf Titan haben die Wissenschaftler im Zuge des Projektes ebenfalls entwickelt. Nach der ersten Forschungsphase im Labor soll in Kürze die präklinische Erprobung folgen. Anwendungspotenziale über die Zahnmedizin hinaus sehen die Experten unter anderem bei Knochenplatten, Hörimplantaten oder künstlichen Gelenken.
Quelle: Karlsruher Institut für Technologie
06.07.2018