News • Molekularer Schalter
Mechanismus hinter Magen-Keim Heliobacter pylori entschlüsselt
Infektionskrankheiten ausgelöst durch Bakterien und andere Mikroben stellen weltweit die häufigsten Todesursachen beim Menschen dar. Etwa die Hälfte der Weltbevölkerung trägt das Bakterium Helicobacter pylori (H. pylori) im Magen, welches als wichtigster Risikofaktor für Geschwüre, MALT-Lymphom und Adenokarzinom im Magen gilt.
Eine erfolgreiche antimikrobielle Therapie dieser Infektion wird zunehmend erschwert durch die rasante Vermehrung von Erregern, die gegen Arzneimittel wie Antibiotika resistent sind. Einem Forschungsteam der Friedrich-Alexander-Universität (FAU) Erlangen-Nürnberg hat jetzt einen neuen Mechanismus aufgeklärt, der ursächlich die Infektion von H. pylori kontrolliert und die Entstehung von Magenerkrankungen einleitet. Diese Befunde könnten zur Entwicklung von neuen Heilverfahren beisteuern. Die Studie wurde in der Fachzeitschrift Nature Communications publiziert.
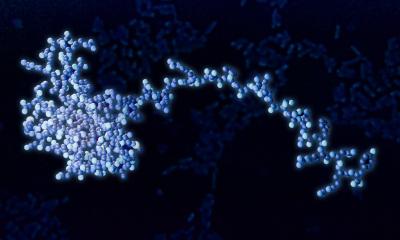
Bild: FAU/Steffen Backert
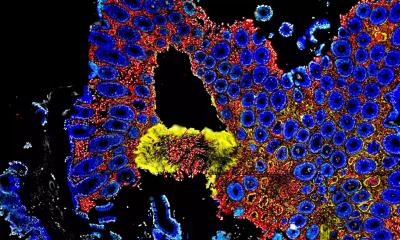
Ein Team aus nationalen und internationalen Wissenschaftlern um Prof. Dr. Steffen Backert vom Lehrstuhl für Mikrobiologie der FAU hat untersucht, wie die Bakterien das Immunsystem im Wirt manipulieren, um das lebenslange Überleben im Magen zu ermöglichen. Grundlage für die Entstehung von entsprechenden Magenerkrankungen ist eine chronische Entzündung. Die Forscher haben hierbei einen „molekularen Schalter“ identifiziert, der über einen neuartigen Mechanismus die Entzündungsreaktion im Magen reguliert. Die Interaktion von H. pylori mit Magenzellen aktiviert einen nadelartigen Fortsatz, den man als Typ-IV-Sekretionssystem bezeichnet. An der Oberfläche dieses Fortsatzes wird ein Protein präsentiert, CagL, welches die Einschleusung eines bakteriellen Giftstoffes, das sogenannte CagA-Protein, in die Magenzellen gewährleistet. Das injizierte CagA wiederum programmiert die Wirtszelle so um, dass sich Magenkrebs entwickeln kann. CagL besitzt aber offenbar eine weitere wichtige Funktion. Das Protein wird durch das Immunsystem über den Rezeptor TLR5 erkannt. Experimente im Mausmodell haben gezeigt, dass TLR5 die Infektion effizient kontrolliert. CagL ahmt dabei ein TLR5-Erkennungsmotiv im Flagellin-Protein von anderen Erregern nach und steuert somit die menschliche Immunantwort.
Interessanterweise kann dieser Signalweg durch das Typ-IV-Sekretionssystem nicht nur ein- sondern auch ausgeschaltet werden, was bei anderen Bakterien nicht bekannt ist. Vermutlich dient dieser Signalweg H. pylori in der jahrtausendlangen Evolution dazu, „lästige“ bakterielle Konkurrenten im Magen zu beseitigen. Gleichzeitig beeinflusst CagL das angeborene und adaptive Immunsystem sowie die Entzündungsreaktion in einer bestimmten Art und Weise, so dass H. pylori selbst nicht erkannt und dadurch auch nicht eliminiert werden kann – ein entscheidender Mechanismus für die dauerhafte Infektion von H. pylori im Magen und die Entstehung von Magenkrankheiten. Die Forscher beobachteten ebenfalls, dass TLR5 in gesunden Magenzellen sowie nach Aufhebung einer Infektion nicht mehr produziert wird. Deshalb stellt die Expression dieses Proteins einen neuen Indikator für H. pylori-vermittelte Magenerkrankungen beim Menschen dar.
Dieser Artikel könnte Sie auch interessieren
News • Neue Therapien
Wie Helicobacter pylori Magenkrebs auslöst
Magenkrebs zählt zu den fünf tödlichsten Krebsarten: Jährlich sterben etwa 750.000 Patienten an dieser Erkrankung, so die Statistik der Weltgesundheitsorganisation WHO. Als Hauptauslöser gilt das Bakterium Helicobacter pylori (H. pylori). Wirkungsvolle Therapien gegen Magenkrebs gibt es derzeit nicht, zunehmende Antibiotikaresistenzen erschweren die Behandlung der Infektion zusätzlich.…
Neuer Ansatz für eine Therapie gegen Magenkrankheiten
Prof. Backert geht davon aus, dass diese Erkenntnisse wichtige neue Ansatzpunkte für die anti-bakterielle Therapie erschließen, da sich CagL, CagA und TLR5 sehr gut als Behandlungsziele eignen. Die beteiligten Forscherinnen und Forscher haben bereits angefangen, entsprechende Wirkstoffe auszutesten. „Wir hoffen, dass spezifische Hemmstoffe die Funktion des Typ-IV-Sekretionssystems lahmlegen bzw. eine Infektion entweder komplett oder partiell unterbinden“, berichtet Prof. Backert.
Quelle: Friedrich-Alexander-Universität (FAU) Erlangen-Nürnberg
18.12.2019